FGF23, hormon kiểm soát chuyển hóa calci - phospho - xương
(Cập nhật marker mới)
PGS.TS.Hà Hoàng Kiệm, BVQY 103, HVQY
1. Đại cương
1.1. Mở đầu
Khi đề cập tới chuyển hóa khoáng – xương, Chúng ta thường nói đến trục nội tiết PTH - vitamin D là trục giữ cân bằng nội môi của xương và chất khoáng. Chức năng chính của trục PTH - vitamin D là duy trì nồng độ calci huyết thanh trong một phạm vi hẹp bằng cách kích thích sản xuất 1α,25(OH)2D3 và giảm bài tiết calci qua nước tiểu. PTH cũng làm tăng lượng calci giải phóng từ xương.
Nhưng khám phá gần đây về yếu tố tăng trưởng nguyên bào sợi 23 (FGF23: Fibroblast Growth Factor 23) thì trục FGF23 - xương - thận trong điều chỉnh chuyển hóa vitamin D và phosphat ở thận đã dẫn đến những hiểu biết mới về sinh lý học và sinh lý bệnh của quá trình chuyển hóa chất khoáng. Trục FGF23 - xương - thận là một phần của hệ thống sinh học mới được phát hiện. FGF23 được tiết ra bởi xương tác động vào thận để điều chỉnh quá trình chuyển hóa phosphat ở thận và chuyển hóa vitamin D, nó liên kết xương với các chức năng các cơ quan khác thông qua một mạng lưới nội tiết phức tạp, được tích hợp với trục PTH - vitamin D và đóng một vai trò quan trọng đối với sức khỏe và bệnh tật. Nguyên bào xương và tế bào hủy xương là nơi chính sản xuất và tiết FGF23. Như vậy, xương không chỉ là nguồn dự trữ chính đối với calci và photphat, mà còn là cơ quan nội tiết liên lạc với các cơ quan khác liên quan đến cân bằng nội môi.
Dư thừa FGF23 làm giảm phosphat máu, giảm 1α,25(OH)2D3, tăng trưởng kém và còi xương / nhuyễn xương. Ngược lại, giảm FGF23 dẫn đến tăng phosphat máu, dư thừa 1α,25(OH)2D3 và vôi hóa mô mềm. Do đó, hầu hết các chức năng sinh lý đã biết của FGF23 trong điều chỉnh trao đổi chất khoáng là do hoạt động của hormone này trên thận.
Có bằng chứng mới cho thấy FGF23 tăng là sự kiện ban đầu phản ứng với mất chức năng thận dẫn đến giảm 1α,25(OH)2D3 và tăng PTH. FGF23 ức chế sản xuất và kích thích dị hóa 1α,25(OH)2D3. Các nghiên cứu cho thấy điều trị bằng kháng thể trung hòa FGF23 đã ngăn chặn sự giảm calcitriol huyết thanh ở chuột mắc bệnh thận mạn (CKD) tiến triển. Khi CKD tiến triển tới suy thận giai đoạn cuối, sự gia tăng nồng độ FGF23 trở nên không thích hợp, có thể góp phần làm suy thận tiến triển nhanh hơn, làm rối loạn chức năng tim, và vôi hóa mạch máu. FGF23 tăng cũng có liên quan đến tăng tỷ lệ tử vong, liên quan đến bệnh tim mạch và liên quan đến tiến triển của CKD.
1.2. Vai trò của các hormon chuyển hóa khoáng – xương
1.2.1. Vai trò của calci
Calci là một phân tử tín hiệu nội bào thiết yếu, nó đóng vai trò rất quan trọng trong rất nhiều quá trình hoạt động của tế bào.
.jpg)
Hình 1. Sơ đồ điều hòa cân bằng calci trong cơ thể.
Hệ thống kiểm soát cân bằng calci rất nhạy cảm với nồng độ calci bên trong và bên ngoài tế bào nhờ vào các hormon điều hòa calci đến các cơ quan như thận, xương và ruột non, tác động đến quá trình huy động, bài tiết và hấp thu calci của tế bào. Có 3 hormon chính là: 1α,25 (OH)2D3, PTH và Calcitonin.
1.2.2. 1α,25 dihydroxycholecalciferol (1α,25 (OH)2D3)
1α,25 dihydroxycholecalciferol (1α,25 (OH)2D3) là một steroid hormon được tạo thành từ vitamin D ở thận và một phần ở gan, đổ vào tuần hoàn máu và được mang bởi globulin gắn vitamin D. Nó làm tăng hấp thu calci ở ruột non.
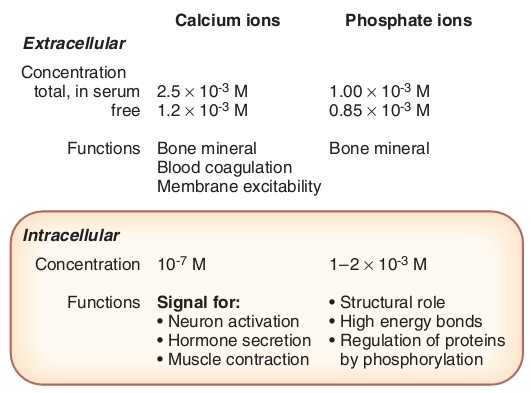
Hình 2: Phân bố và vai trò của Ca2+ và phosphat.
1.2.3. Parathyroid hormone (PTH)
PTH là hormon tuyết cận giáp, cấu tạo phân tử là một chuỗi polypeptid đơn có 84 amino acid, trọng lượng phân tử 9500 Da. Chức năng sinh lý của nó liên quan đến vị trí đầu N của peptid. Từ tiểu phân 1 đến tiểu phân 27 là vị trí gắn của hormon với thụ thể PTH và tạo hoạt tính của hormon. PTH được tiết ra ở tuyến cận giáp, có vai trò chính là huy động calci từ xương và tăng hấp thu calci từ ruột non, giảm thải calci và tăng thải phosphat qua thận. Khi nồng độ huyết thanh của Ca2+ dưới 7mg/dL (1,75 mM/l), sự bài tiết Ca2+ sẽ giảm. Ở xương, PTH tham gia cả quá trình đồng hóa và dị hóa xương. Trong ống nghiệm, nó tác động lên tạo cốt bào bằng cách ức chế sự hình thành collagen týp 1, phosphatase kiềm và osteocalcin. Nhưng trong tế bào, người ta lại thấy nó tăng hoạt tính của osteoblast và do vậy nồng độ osteocalcin và phosphatase kiềm đôi lúc lại tăng (năm 2008 người ta còn phát hiện một số thụ thể của PTH ở hủy cốt bào, được mô tả ở hình dưới). PTH hoạt động qua lộ trình tín hiệu của cAMP là chủ yếu và một phần rất nhỏ qua lộ trình của Ca2+ nội bào.
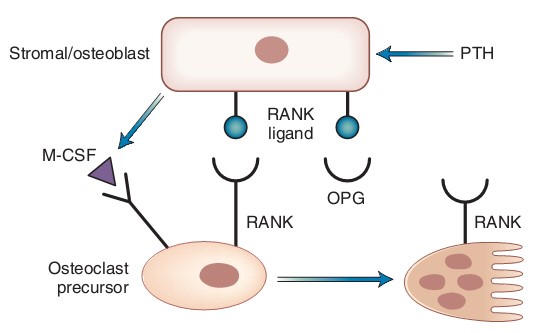
Hình 3. PTH tác động trên thụ thể PTH/PTH-related protein (PTHrP) có ở tiền tạo cốt bào để tăng sản xuất macrophage colony-stimulating factor (M-CSF), ligand của thụ thể hoạt hóa NFκB (RANK) và giảm sản xuất osteoprotegerin (OPG). Ligand của M-CSF và RANK kích hoạt sản xuất hủy cốt bào và tăng hoạt tính của hủy cốt bào trưởng thành bằng cách gắn vào thụ thể RANK. OPG khóa sự tương tác giữa RANK và ligand của nó.
1.2.4. Calcitonin
Calcitonin (còn được gọi là thyrocalcitonin) là một hormon polypeptid dạng thẳng gồm 32 acid amin được sản xuất bởi cáctế bào cận nang (còn được gọi là tế bào C) của tuyến giáp, hormon này có vai trò giảm nồng độ của calci trong máu, đối nghịch với vai trò của PTH. Thời gian bán hủy của calcitonin là khoảng 10 phút. Sự tiết calcitonin được hoạt hóa bởi nồng độc calci máu cao, catecholamin, glucagon, gastrin và cholecystokinin và tình trạng tiết bất thường liên quan đến tình trạng carcinoma tủy giáp hoặc tăng sản tế bào C tuyến giáp do vậy có thể đóng vai trò như một marker.
1.2.5. FGF23 (Fibroblast Growth Factor 23)
Yếu tố tăng trưởng nguyên bào sợi 23 hay FGF23 là một protein ở người mới được phát hiện trong những năm gần đây, được mã hóa bởi gen FGF23 nằm trên nhiễm sắc thể 12. FGF23 được tiết ra bởi tế bào xương (nguyên bào xương và tế bào hủy xương) để đáp ứng với calcitriol (1α,25 (OH)2D3) tăng cao . FGF23 hoạt động ở thận, nơi nó làm giảm sự hoạt động của NPT2, một chất đồng vận chuyển natri - phosphat ở ống lượn gần. Do đó, FGF23 làm giảm tái hấp thu calci và tăng bài tiết phosphat, hay nói cách khác nó là chất làm giảm phosphat máu và giảm calci máu.
FGF23 là một thành viên của họ yếu tố tăng trưởng nguyên bào sợi (FGF) tham gia vào quá trình chuyển hóa và điều hòa phosphat và vitamin D.
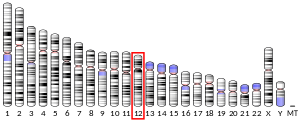
Hình 4. Vị trí gen FGF23 (Người). Các gen FGF23 nằm trên nhiễm sắc thể 12 ở người và nhiễm sắc thể 6 ở chuột và kéo dài hơn 8,5 kb. Nó được cấu tạo bởi 3 exon cách nhau bởi 2 intron và mã hóa một glycoprotein 32 kDa chứa 251 gốc axit amin.
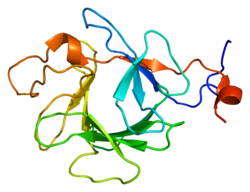
Hình 5. Mô hình cấu trúc phân tử FGF23. Protein này bao gồm chuỗi tín hiệu kỵ nước 24 axit amin, đầu cuối NH2 của 154 axit amin chứa vùng tương đồng lõi FGF và 73 axit amin đặc trưng vùng đầu tận cùng COOH. Sau khi phân tách của các axit amin 24 tín hiệu theo thứ tự, và O -glycosylation bởi UDP- N -acetyl-α- d -galactosamine: polypeptide N -acetylgalactosaminyl-transferase 3 (GALNT3), protein trưởng thành 25- FGF23 -251được tiết vào vòng tuần hoàn.
FGF23 (yếu tố tăng trưởng nguyên bào sợi 23) có vai trò quan trọng trong sự chuyển hóa phosphat bình thường. Tăng quá mức nồng độ FGF23 sẽ gây nên tình trạng giảm phosphat máu và giảm hoạt tính của 1α-hydroxylase, là chất hoạt hóa 25(OH)D (calcidiol) do đó làm giảm nồng độ 1α,25 (OH)2D3 (calcitriol). Ngoài ra, FGF23 còn làm giảm các kênh tải phosphat phụ thuộc Na+ ở cả ruột non và thận do vậy nó cũng đóng vai trò điều hòa hoạt động vận chuyển phosphat ở cả hai vị trí này. FGF23 làm giảm nồng độ calcitriol lưu hành trong máu bởi vì tác động vào giai đoạn dịch mã của quá trình tổng hợp 25(OH)D 1α-hydroxylase và tăng hoạt động của 24-hydroxylase (enzyme có vai trò chính trong việc bất hoạt calcitriol). FGF23 hoạt hóa thụ thể FGF có mặt ở Klotho (một protein xuyên màng chuỗi đơn, có vai trò như một đồng thụ thể). Người ta thử nghiệm trên chuột loại bỏ gen mã hóa Klotho thì thấy rằng nồng độ phosphat và calcitriol đều tăng lên, điều này cho thấy rằng Klotho là trung gian điều hòa hoạt tính của FGF23.
2. Nguồn gốc của FGF23
2.1. Gia đình FGF (Fibroblast Growth Factor)
FGF có liên quan đến các chức năng đa dạng bao gồm phát triển, sửa chữa hoặc chuyển hóa, tất cả đều bắt nguồn từ gen tổ tiên giống FGF13 và chia sẻ miền cấu trúc lõi được bảo tồn xấp xỉ 120 phần tử với xấp xỉ 30-60% nhận dạng, tạo cơ sở cho việc phân loại chúng. Họ gen FGF của người / chuột bao gồm 22 thành viên từ FGF1 đến FGF23 (trong đó FGF15 và FGF19 là ortholog ở động vật có xương sống, FGF15 không có ở người và FGF19 không có ở chuột). Họ FGF có thể được chia thành bảy phân họ phát sinh loài bao gồm ba nhóm theo cơ chế hoạt động của chúng: gen nội bào, gen chuẩn và gen FGF giống hormone.
Nhóm FGF nội bào bao gồm phân họ FGF 11/12/13/14. Các FGF này hoạt động như các phân tử tín hiệu nội bào theo cách thức phụ thuộc vào thụ thể FGF (FGFR).
Nhóm FGF chuẩn bao gồm các phân họ FGF 1/2/5, FGF 3/4/6, FGF 7/10/22, FGF 8/17/18 và FGF 9/16/20. Các FGF Canonical làm trung gian cho các phản ứng sinh học của chúng dưới dạng protein ngoại bào bằng cách liên kết và hoạt hóa tyrosine kinase FGFR trên bề mặt tế bào với heparin / heparan sulfate như một đồng yếu tố. Chúng hoạt động như các phân tử tín hiệu cục bộ theo cách tự nội tiết / nội tiết.
Nhóm FGF giống hormone hoặc nội tiết bao gồm phân họ FGF 19/21/23. Ngược lại với nhóm FGF chuẩn, FGF giống như hormone hoạt động một cách hệ thống như các yếu tố nội tiết. Tuy nhiên, chúng cũng làm trung gian cho phản ứng của mình thông qua các cơ chế phụ thuộc FGFR.
2.2. FGF giống hormon
- Phân họ nội tiết:
Trái ngược với FGF nội bào và FGF chuẩn được xác định ở động vật không xương sống và động vật có xương sống, FGF giống hormon, FGF 15/19, FGF 21 và FGF 23, là đặc trưng cho động vật có xương sống. Các FGF giống hormon có chức năng nội tiết bằng cách giảm ái lực liên kết với heparin và sự hiện diện của nhóm cuối COOH mới cho phép kích hoạt các thụ thể FGF khi không có heparin. Cụ thể, sự thay đổi cấu trúc xảy ra chủ yếu ở vùng β10 - β12 có chứa các gốc chiếm ái lực với heparin. Một mặt, ái lực liên kết yếu với heparin của các FGF nội tiết ngăn cản chúng bị bắt giữ trong chất nền ngoại bào và do đó cho phép chúng hoạt động như các yếu tố nội tiết tuần hoàn. Nhiều mô biểu hiện một hoặc nhiều đồng dạng FGFR có khả năng hoạt động như các thụ thể cho FGF. Do đó, sự biểu hiện của đồng yếu tố trong mô xác định cơ quan đích của bất kỳ FGF nội tiết nào để kiểm soát sự trao đổi chất và đảm bảo tính đặc hiệu của nội tiết tố.
Hoạt động của FGF23 yêu cầu cofactor αKlotho. FGF23 điều chỉnh nồng độ photphat trong huyết thanh và vitamin D hoạt động.
- FGF23:
FGF23 là thành viên của phân họ FGF19 của FGF nội tiết, cũng bao gồm FGF 15/19 và FGF21. FGF23 có tương đồng cao nhất với FGF21. FGF23 lần đầu tiên được xác định trong nhân đồi thị hai bên ở não chuột, và ở những bệnh nhân mắc bệnh còi xương giảm phosphat máu (ADHR) thấy FDF23 huyết thanh tăng rất cao, điều đó cho thấy tầm quan trọng của nó. Gen FGF23 đột biến dẫn đến bệnh ADHR tạo ra khả năng chống lại sự phân cắt protein FGF23 và do đó làm tăng nồng độ FGF23 hoạt động kéo dài trong huyết thanh và sự phát triển của bệnh. FGF23 chủ yếu được bài tiết bởi các tế bào hủy xương và nguyên bào xương ở trong xương, nhưng nó cũng được tiết ra bởi các tuyến nước bọt, dạ dày và ở nồng độ thấp hơn nhiều bởi các mô khác, bao gồm cơ xương, não, tuyến vú, gan và tim.
Trong máu, protein FGF23 lưu thông dưới hai dạng riêng biệt: dạng trưởng thành có chiều dài đầy đủ ( 25- FGF23 -251 ) và dạng ngắn hơn ( 25- FGF23 -179 ) thiếu đuôi đầu tận cùng 73 axit amin duy nhất. Dạng ngắn hơn phát sinh từ sự phân cắt protein ở vị trí 176 RXXR 179, theo sau vùng β10 – β12 của vùng tương đồng lõi FGF của FGF23. Chỉ có dạng độ dài đầy đủ của FGF23 là hoạt động, vì miền đầu cuối COOH là cần thiết cho sự tương tác với đồng yếu tố αKlotho và kích hoạt xuôi dòng tín hiệu FGFR. O -glycosyl hóa của FGF23 xảy ra ở vùng 162–228 chồng lên vị trí phân cắt 176 RXXR 179, và sự biến đổi sau chuyển dịch này dường như bảo vệ FGF23 khỏi bị phân cắt bởi các chuyển đổi proprotein.
Những con chuột đột biến FGF23 đã được tạo ra để xác định chức năng của FGF23. Sự tăng quá mức nồng độ FGF23 ở động vật chuyển gen hoặc sử dụng FGF23 qua đường tiêu hóa cho động vật gặm nhấm thấy ức chế tái hấp thu phosphat làm tăng thải phosphat qua nước tiểu và ức chế tổng hợp calcitriol (1α,25 (OH)2D3) trong ống thận gần. Ngược lại, chuột không có FGF23 hoặc người có đột biến gen đồng hợp tử ở FGF23 phát triển chứng tăng phosphat máu nghiêm trọng, tăng mức 1α,25 (OH)2D3 và vôi hóa mô mềm.
3. Chức năng của FGF23
3.1. Klotho và phức hợp thụ cảm thể FGF (FGFR)
- Klotho và độ đặc hiệu mô:
Klotho là thụ cảm thể của các FGF, là một protein xuyên màng. Các gen Klotho mã hóa các protein cofactor truyền đạt hoạt động đặc hiệu mô của các FGF nội tiết không phụ thuộc vào heparin.
βklotho là một protein xuyên màng thấy trong mô mỡ, gan và tuyến tụy. Chuột thiếu βklotho có kiểu hình trùng lặp với chuột thiếu FGF15 hoặc FGFR4.
αKlotho được phát hiện trong khi nghiên cứu kiểu hình của chuột chuyển gen biểu hiện quá mức chất trao đổi natri-proton loại I ở thỏ. Một con vật biểu hiện kiểu hình giống như lão hóa, gây ra bởi đột biến chèn của gen Klotho. Các động vật đồng hợp tử cho gen chuyển được chèn vào có tuổi thọ ngắn hơn và phát triển sớm các bệnh lý liên quan đến lão hóa bao gồm loãng xương, thiểu năng tuyến sinh dục, xơ cứng động mạch, teo da, khí phế thũng phổi, thoái hóa thần kinh và thính giác.
αKlotho tìm thấy chủ yếu ở thận và biểu mô của đám rối màng mạch trong não. Ngoài các mô này, αklotho cũng được tìm thấy số lượng ít ở tuyến yên, nhau thai, cơ xương, bàng quang, động mạch chủ, tuyến tụy, tinh hoàn, buồng trứng và ruột kết. Ngoài ra còn thấy αklotho trong tuyến cận giáp và các tế bào xoang nhĩ của tim.
Các cơ quan đích của FGF23 được xác định bằng sự có mặt của αKlotho và FGFRs ở màng tế bào. Tầm quan trọng của protein màng αKlotho trong việc truyền tín hiệu FGF23 được minh họa bởi các rối loạn di truyền ở cả người và chuột, nơi mất αKlotho dẫn đến kháng FGF23 ở cơ quan đích, các bất thường biểu hiện giống như thiếu FGF23. Các nghiên cứu đã xác định αKlotho là đồng yếu tố cần thiết cho FGF23, tạo phức với FGFRs và tăng ái lực của chúng với FGF23.
- Klotho hòa tan:
Mặc dù các chức năng chính xác của Klotho hòa tan vẫn chưa được xác định, Klotho lưu hành trong máu có thể phát sinh từ sự gia tăng phiên mã gen của isoform được tiết ra nối tiếp nhau hoặc từ sự tiết ra ectodomain của vùng ngoại bào màng của αKlotho có chiều dài đầy đủ. Ngoài ra, gen αKlotho mã hóa một dạng cắt ngắn, được tiết ra từ quá trình nối RNA thay thế.
Klotho hòa tan hoạt động như một yếu tố thể dịch, có khả năng thông qua một thụ thể Klotho trên bề mặt tế bào chưa biết, và như một enzyme điều chỉnh một số glycoprotein bề mặt tế bào.
Cuối cùng, bằng chứng mới cho thấy rằng thiếu Klotho là dấu hiệu sinh học sớm cho bệnh thận mãn tính (CKD). Thiếu Klotho có liên quan đến sự tiến triển và các biến chứng mạn tính trong bệnh thận mạn bao gồm vôi hóa mạch máu và phì đại tim trong các nghiên cứu trên động vật và người, và việc thay thế Klotho hòa tan và / hoặc biểu hiện quá mức cưỡng bức có tác dụng bảo vệ thận khỏi tổn thương, bảo tồn chức năng thận và ngăn chặn xơ hóa thận.
- Các thụ thể FGF (FGFR):
Các FGFR của động vật có vú được mã hóa bởi 4 gen riêng biệt (FGFR1 - FGFR4). FGF23 liên kết với phức FGFR - αKlotho có ái lực cao hơn nhiều so với FGFR đơn thuần, và tín hiệu FGF23 là tối đa khi liên kết với phức FGFR1c-αKlotho. Giả thuyết cơ chế sinh học của FGF23 với αKlotho là việc các FGFR tạo thành các phức hợp truyền tín hiệu thông qua dòng thác protein kinase hoạt hóa mitogen. Bằng cách tương tác với phức hợp FGFR-αKlotho, FGF23 bắt đầu các sự kiện truyền tín hiệu xuôi dòng thông qua nhiều loại protein báo hiệu nội bào.
3.2. Đối với thận
Hậu quả chính của việc dư thừa FGF23 là giảm phosphat máu do mất phosphat qua nước tiểu, giảm 1α,25(OH)2 D3, tăng trưởng kém và còi xương / nhuyễn xương. Ngược lại, thiếu hụt FGF23 dẫn đến tăng phosphat máu, dư thừa 1α,25(OH)2D3 và vôi hóa mô mềm. Do đó, hầu hết các chức năng sinh lý đã biết của FGF23 để điều chỉnh sự trao đổi chất khoáng có thể được giải thích bởi các hoạt động của hormon này trên thận. Một mặt, việc giảm nồng độ 1α,25(OH)2 D3 trong tuần hoàn để đáp ứng với sự dư thừa FGF23 là thông qua việc ức chế 25-hydroxyvitamin D 1α-hydroxylase và kích thích 1α,25-dihydroxyvitamin D 24-hydroxylase trong các ống lượn gần. Giảm phosphat máu do dư thừa FGF23 là do ức chế chất vận chuyển photphat phụ thuộc natri ở đoạn ống lượn gần của thận.
3.2.1. Đối với chuyển hóa vitamin D
Chức năng sinh lý đặc trưng nhất của FGF23 là hoạt động như một hormon điều hòa vitamin D. Trước khi phát hiện ra FGF23, người ta cho rằng quá trình điều hòa phosphat xảy ra như một hoạt động thứ cấp của PTH và 1α,25(OH)2D3. Trong các rối loạn giảm phosphat máu do dư thừa FGF23, mức 1α,25(OH)2D3 bị ức chế bất thường vì khi giảm phosphat máu, lẽ ra sẽ làm tăng mức 1α,25(OH)2D3. Ở đây FGF23 làm giảm mức 1α,25(OH)2D3 do tác động phức tạp lên Cyp27b1 và Cyp24a1 để giảm sản xuất và tăng dị hóa 1α,25(OH)2D3. Các nghiên cứu chứng minh rằng FGF23 tăng lên sẽ ức chế Cyp27b1 và kích thích hoạt động Cyp24a1, điều này ngược lại với những gì người ta dự đoán khi có mức PTH tuần hoàn cao và đồng thời giảm phosphate máu.
Điều chú ý là, tác động kích thích của FGF23 lên Cyp24a1 và giảm nồng độ 1α,25(OH)2D3 trong huyết thanh là cơ chế phụ thuộc vào thụ thể vitamin D. Còn ảnh hưởng của FGF23 trên Cyp27b1 không thống nhất trong các tài liệu hiện có. Tiêm FGF23 tái tổ hợp cho chuột hoang dã dẫn đến giảm lượng Cyp27b1 ở thận phụ thuộc vào liều lượng và tác động trực tiếp lên biểu hiện gen Cyp27b1 trong tế bào ống lượn gần của người và chuột. Ở chuột Hyp, chuột đồng dạng về bệnh còi xương giảm phosphat máu liên kết X hiển thị FGF23 dư thừa, các khiếm khuyết trong quá trình dịch mã Cyp27b1 cũng đã được báo cáo.
3.2.2. Đối với tái hấp thu photphat
Thận đóng vai trò trung tâm trong việc giữ cân bằng phosphat. Nó điều chỉnh sự bài tiết phosphat qua nước tiểu và duy trì nồng độ phosphat huyết thanh trong phạm vi hẹp. Phosphat được tái hấp thu hầu như chỉ ở ống thận gần qua con đường xuyên tế bào. Bước hạn chế của hệ thống vận chuyển xuyên biểu mô này là sự xâm nhập của phosphat ở vùng đỉnh của các tế bào ống lượn gần. Quá trình này yêu cầu các đồng vận chuyển photphat phụ thuộc natri sử dụng gradien natri bên trong được thiết lập và duy trì bởi hoạt động của bơm Na + -K +- ATPase. Có ba loại chất đồng vận chuyển phốt phát phụ thuộc natri trong tế bào ống thận:
- Chất đồng vận chuyển loại 1 (NPT1) là chất vận chuyển anion không làm trung gian chuyên chở phốt phát.
- Họ đồng vận chuyển (cotransporter) loại 2 bao gồm ba chất mang: NPT2a (được mã hóa bởi gen SLC34a1), NPT2b (được mã hóa bởi gen SLC34a2) và NPT2c (được mã hóa bởi gen SLC34a3).
- Chất đồng vận chuyển loại 3 bao gồm hai chất vận chuyển: PiT1 (được mã hóa bởi gen SLC20a1) và PiT2 (được mã hóa bởi gen SLC20A2).
FGF23 ngăn chặn sự hoạt động của NPT2a và NPT2c và do đó làm tăng bài tiết phosphat qua nước tiểu. NPT2a là trung tâm của tái hấp thu phosphat ở thận và giữ cân bằng phosphat, và hầu như chỉ được tìm thấy ở màng đỉnh của tế bào ống thận gần. NPT2c là dạng đồng phân biểu hiện ở màng diềm bàn chải của tế bào ống thận gần. Do ảnh hưởng của FGF23 đối với chuyển hóa vitamin D và PTH, người ta đã đưa ra giả thuyết rằng sự điều hòa NPT2 của FGF23 có thể là do giảm mức 1α,25(OH)2D3 trong huyết thanh và / hoặc PTH tăng. Tuy nhiên, những hoạt động này không phụ thuộc vào vitamin D, và ảnh hưởng của FGF23 đối với phosphat huyết thanh có thể được quan sát thấy ở chuột đã được mổ cắt tuyến cận giáp.
Trong khi tác động của FGF23 lên đồng dạng NPT2c dường như có thể thay đổi, việc tiếp xúc liên tục với FGF23 tái tổ hợp được chứng minh là gây ra tăng thanh thải phosphat ở thận do giảm hoạt động NPT2a ở thận. Những con chuột chuyển gen biểu hiện dư thừa FGF23 bị tăng thải photphat qua nước tiểu nghiêm trọng do ức chế hoạt động của NPT2 ở thận. Ngược lại, chuột thiếu FGF23 có biểu hiện tăng phosphat máu nghiêm trọng và vôi hóa mô mềm có tăng hoạt động NPT2a ở thận. Phục hồi hệ thống của FGF23 ở chuột thiếu FGF23 đã làm đảo ngược tình trạng tăng phosphat máu thành giảm phosphat máu và ngăn ngừa vôi hóa mô mềm.
3.2.3. Cơ chế chức năng của FGF23 ở thận
Tương tác giữa αKlotho và FGFR là cần thiết để làm trung gian truyền tín hiệu cho FGF23. Đầu tiên, ít nhất ba FGFR khác nhau có biểu hiện tăng ái lực với FGF23 khi tạo phức với αKlotho. Thứ hai, đồng yếu tố giới hạn αKlotho khu trú chủ yếu ở ống thận xa, và các phản ứng sinh học FGF23 trên đồng dạng NPT2 và các enzym chuyển hóa vitamin D được quan sát thấy trong các ống gần. Do đó, có sự tồn tại FGFR có liên quan về mặt sinh lý đối với FGF23 trong thận và các phân đoạn ống thận chính xác được FGF23 nhắm mục tiêu.
3.2.4. Cơ chế phản hồi nội tiết của ống lượn xa đến ống lượn gần
Cơ chế cơ bản về tác dụng của FGFRs điều chỉnh chuyển hóa phosphat ở ống lượn gần và vitamin D đến nay chưa được hiểu rõ ràng, cofactor giới hạn αKlotho, được biểu hiện chủ yếu ở ống lượn xa. Mức cao nhất của phức hợp FGFR-αKlotho thấy ở các ống lượn xa, trong khi các hoạt động sinh học của FGF23 được quan sát thấy lại ở các ống lượn gần, về mặt lý thuyết phải loại trừ ảnh hưởng trực tiếp của FGF23 đối với các ống lượn gần. Ngoài ra, các hoạt động của FGF23 trên ống lượn gần có thể là gián tiếp, có thể thông qua sự kích thích FGF23 của ống lượn xa và giải phóng các yếu tố nội tiết điều chỉnh chức năng của ống lượn gần (tức là “cơ chế phản hồi từ ống lượn xa đến ống gần”) trong đó protein Klotho hòa tan có thể là ứng cử viên lý tưởng. Cơ chế này có thể thực hiện được trong cơ thể sống nhờ sự gần gũi của các tế bào ống lượn gần và ống lượn xa, và được hỗ trợ bởi các nghiên cứu cho thấy αKlotho có thể được giải phóng vào hệ tuần hoàn từ ống lượn xa bằng cách tiết ra ectodomain hoặc tiết ra đồng dạng αKlotho thiếu miền xuyên màng. Theo đó, FGF23 làm giảm sự biểu hiện của αKlotho ở thận, do đó tạo ra các con đường phản hồi phức tạp để điều chỉnh chuyển hóa photphat và canxi. Sự biểu hiện quá mức của αKlotho gây ra tăng phosphat niệu. Điều này ủng hộ giả thuyết về việc Klotho tiết ra làm trung gian cho một số tác động của FGF23. Việc phân biệt giữa tác động trực tiếp và gián tiếp của FGF23 lên chức năng ống thận cần có các nghiên cứu bổ sung.
4. Vai trò sinh lý của FGF23
Việc phát hiện ra FGF23, cơ chế điều hòa và chức năng của nó, đã dẫn đến một cơ chế bệnh sinh mới để phân loại các rối loạn tang và giảm phosphat máu di truyền và mắc phải, xem xét lại các phương pháp điều trị để quản lý các rối loạn giảm phosphat máu di truyền, mới hiểu rõ cơ chế bệnh sinh của rối loạn chuyển hóa khoáng trong bệnh thận mạn tính, tìm hiểu cơ chế của tăng phosphat máu do các loại thuốc khác nhau gây ra và xác định các mối liên hệ có thể có giữa rối loạn chuyển hóa khoáng và tử vong do tim mạch.
4.1. Ý nghĩa sinh lý của FGF23
Hơn 85% tổng lượng photphat trong cơ thể được lưu trữ trong xương ở cả chất nền khoáng hóa và các hồ có thể trao đổi. Phosphat di chuyển vào và ra khỏi xương (thường cùng với calci) theo cách phối hợp với quá trình khoáng hóa xương và tái tạo xương, việc thận xử lý photphat, hấp thụ photphat từ thức ăn và tình trạng axit-bazơ. Ngoài photphat ngoại bào rất quan trọng đối với sự khoáng hóa của chất nền xương, photphat nội bào rất quan trọng đối với quá trình chuyển hóa năng lượng và tín hiệu nội bào. Các chức năng chuyển hóa liên quan đến phosphat nội bào nhạy cảm nhất với giảm phosphat máu, trong khi thừa phosphat vượt qua tác dụng ức chế của protein nền Gla và các yếu tố khác để gây ra vôi hóa ngoài xương và ảnh hưởng không tốt đến hệ tim mạch và các mô mềm dẫn đến tăng tỷ lệ mắc bệnh và tử vong. Khả năng của phosphate dư thừa thúc đẩy quá trình calci hóa mô mềm liên quan đến sự luân chuyển xương, do đó trạng thái chu chuyển xương thấp có liên quan đến sự gia tăng vôi hóa mạch máu. Khả năng đệm của xương đối với phosphat là một thực thể khó định lượng, nhưng ảnh hưởng của nó đối với cân bằng nội môi phosphat toàn thân được quan sát gián tiếp trong các rối loạn lâm sàng, chẳng hạn như cường cận giáp nặng trong bệnh thận mạn tính, nơi lượng phosphat dư thừa từ xương góp phần vào cả tăng phosphat huyết và calci huyết thanh. Mức độ giảm nhanh chóng nồng độ PTH xảy ra khi phẫu thuật cắt tuyến cận giáp dẫn đến giảm phosphat máu và hạ calci máu do tăng hấp thu canxi và phosphat trong “hội chứng xương đói”. Với chức năng chứa và đệm của xương trong cân bằng nội môi phosphate, và độc tính của phosphate dư thừa trong tuần hoàn. Các tín hiệu điều tiết phát sinh từ xương để điều phối sự luân chuyển xương và quá trình khoáng hóa với cân bằng nội môi phosphat toàn thân là điều cần thiết.
Tăng quá mức 1α,25(OH)2D3 có thể có độc tính do tác dụng làm tăng hấp thu canxi và photphat qua đường tiêu hóa và kích thích RANKL trong xương dẫn đến tăng tạo cốt bào. Calci máu tăng lên sẽ ngăn chặn bài tiết PTH thông qua việc kích hoạt CASR trong các tuyến cận giáp. Giảm PTH sẽ làm giảm sản xuất 1α,25(OH)2D3 của thận. Để ngăn ngừa tăng phosphat máu trong bối cảnh tăng 1α,25(OH)2D3 và giảm PTH cần có thêm một bộ điều chỉnh xử lý phosphat ở thận.
Còn nhiều điều cần được khám phá về chức năng của FGF23. Giả thuyết cho rằng các chức năng sinh lý chính của FGF23 là hormone này có chức năng bảo vệ sinh vật khỏi tác động độc hại của lượng phosphate dư thừa và 1α,25(OH)2D3.
4.2. Giảm phosphat máu do dư thừa FGF23
Có bốn chứng rối loạn di truyền do đột biến gen đơn lẻ có liên quan đến việc tăng nồng độ FGF23. Chúng bao gồm:
- Đột biến của vị trí RXXR của sự phân cắt FGF23 trong bệnh còi xương giảm phosphat huyết trội ở thể nhiễm sắc (ADHR).
- Bất hoạt đột biến của Phex, một endopeptidase bề mặt tế bào, trong XLH.
- Đột biến bất hoạt của DMP1 ở bệnh còi xương giảm phosphate huyết ở thể nhiễm sắc thể 1 (ARHR1).
- Bất hoạt ectonucleotide pyrophosphatase / phosphodiesterase 1 (ENPP1), một loại enzyme tạo ra pyrophosphate, trong bệnh còi xương do di truyền lặn giảm phosphate huyết ở thể nhiễm sắc thể 2 (ARHR2).
Dấu hiệu sinh hóa của thừa FGF23 trong những rối loạn này là giảm phosphat huyết, nồng độ α,25(OH)2D3 thấp hoặc bình thường không thích hợp, còi xương và / hoặc nhuyễn xương phản ánh phần lớn ảnh hưởng trên xương của chứng tăng phosphate huyết. Cường cận giáp thường xuất hiện ở trạng thái dư thừa FGF23, có thể do giảm 1α,25(OH)2D3 qua trung gian FGF23.
Bốn đột biến này cũng cung cấp những hiểu biết sâu sắc về các cơ chế điều chỉnh bổ sung và chức năng sinh lý của FGF23.
Một đột biến sai gen đơn lẻ khác trên FGFR1 dẫn đến chứng loạn sản xương (OGD) và dẫn đến tăng FGF23 và giảm phosphat huyết, nhưng có các bất thường về xương khác nhau và các đặc điểm lâm sàng bổ sung. Tuy nhiên, những bất thường bệnh lý này có thể cung cấp manh mối cho chức năng sinh lý của FGF23, và một lý do có thể là hormon phốt phát này chủ yếu được sản xuất trong xương, là cung cấp một con đường để điều phối khả năng đệm phosphat của xương liên quan đến quá trình khoáng hóa xương và sự luân chuyển với thận, điều chỉnh phosphat để duy trì cân bằng nội môi phosphate toàn thân.
Cuối cùng, một sự chuyển vị liền kề với gen αKlotho đã được báo cáo ở một cá thể riêng lẻ dẫn đến tăng nồng độ αKlotho và FGF23 trong tuần hoàn, cường cận giáp và bệnh xương chuyển hóa còi xương giảm phosphate máu và cường cận giáp. FGF23 nhắm vào các phức hợp FGFR - Klotho trong màng tế bào. Sự chuyển vị dẫn đến tăng mức độ lưu hành của αKlotho cho thấy rằng Klotho lưu thông cũng có thể điều chỉnh các con đường kích thích FGF23 cũng như sản xuất PTH.
Nghiên cứu sâu hơn là cần thiết để hiểu mối quan hệ qua lại giữa tái tạo xương, PTH, vitamin D, Klotho và FGF23. Hiểu được các cơ chế phân tử liên kết quá trình khoáng hóa xương, chuyển hóa vitamin D và sản xuất FGF23 mang lại tiềm năng phát triển các liệu pháp điều trị hiệu quả và an toàn hơn cho các rối loạn giảm phosphat huyết di truyền và mắc phải. Mức độ FGF23 cũng được chứng minh là quan trọng trong việc chẩn đoán các rối loạn tăng phosphat máu và giảm phosphat máu do di truyền và mắc phải. Ngoài ra, mối liên hệ giữa 1α,25(OH)2D3 và FGF23 đã đặt ra câu hỏi về việc sử dụng hiện tại các chất tương tự vitamin D hoạt tính để điều trị XLH, gần đây đã được chứng minh là làm tăng thêm FGF23 ở bệnh nhân XLH .
4.3. Tăng phosphat máu do thiếu hụt FGF23
Có một số bệnh tăng phosphat máu do thiếu hụt FGF23 bao gồm các đột biến bất hoạt của GALNT3 (HFTC), FGF23, và Klotho. Tất cả những đột biến này dẫn đến hội chứng lâm sàng của bệnh vôi hóa do khối u tăng phốt phát được đặc trưng bởi vôi hóa mô mềm, tăng phốt phát huyết và tăng nồng độ 1α,25(OH)2D3 trong huyết thanh do thiếu hụt FGF23. Đột biến của GALNT3 làm giảm sự ổn định của FGF23, trong khi đột biến Klotho ngăn cản sự hình thành phức hợp với FGF23 và dẫn đến giảm tín hiệu FGF23.
4.4. FGF23 trong Rối loạn khoáng xương không di truyền
FGF23 mở ra một cơ chế sinh học mới để hiểu bệnh sinh của rối loạn chuyển hóa xương và khoáng chất trong các bệnh thận mạn tính và rối loạn cân bằng phosphat ảnh hưởng như thế nào đến chức năng của các cơ quan ngoài xương, bao gồm bệnh tim mạch, vôi hóa mạch máu và chuyển hóa năng lượng.
4.4.1. Suy thận
Bệnh thận mạn (CKD) dẫn đến tăng PTH, tăng FGF23 và giảm nồng đô 1α,25(OH)2D3 trong tuần hoàn máu, hạ calci máu, tăng phosphat máu, bệnh xương, vôi hóa mạch máu và bệnh tim mạch, được gọi chung là bệnh thận mạn tính và rối loạn khoáng xương (CKD-MBD ). Cơ chế bệnh sinh của CKD-MBD theo truyền thống được nhìn nhận từ quan điểm của trục PTH - vitamin D, và các phương pháp điều trị hiện tại tập trung vào việc ngăn chặn PTH bằng các chất tương tự vitamin D hoạt động. Trước khi phát hiện ra FGF23, loạn dưỡng xương thứ phát trong quá trình tiến triển của bệnh thận mạn được cho là do sự suy giảm sản xuất 1α,25(OH)2D3 qua trung gian Cyp27b1 ở ống lượn gần do mất khối lượng thận. Tuy nhiên, có bằng chứng mới cho thấy FGF23 tăng để phản ứng với mất chức năng thận là sự kiện ban đầu dẫn đến giảm 1α,25(OH)2D3 và tăng PTH. Các nghiên cứu cắt ngang ở người cho thấy tăng FGF23 sớm ở CKD tương ứng với giảm GFR và tăng cao hơn ở bệnh thận giai đoanh cuối (ESRD). Mức tăng FGF23 tương quan với mức độ tăng phốt phát trong máu và dự đoán cường tuyến cận giáp ở bệnh nhân bệnh thận giai đoạn cuối. Vì FGF23 ức chế sản xuất và kích thích dị hóa 1α,25(OH)2D3 thông qua ức chế Cyp27b1 và sự kích thích Cyp24. Mức giảm 1α,25(OH)2D3 trong CKD có thể không đại diện cho trạng thái “thiếu vitamin D” thực sự. Thay vào đó, sự ức chế mức 1α,25(OH)2D3 trong tuần hoàn qua trung gian FGF23 là một phản ứng thích ứng, giúp bảo vệ chống lại sự tăng phosphat huyết thông qua việc giảm tác động của 1α,25(OH)2D3 lên hấp thu phosphate ở đường tiêu hóa. Cơ chế hoạt động này được hỗ trợ bởi các nghiên cứu cho thấy rằng điều trị bằng kháng thể trung hòa FGF23 ngăn chặn được sự giảm calcitriol huyết thanh ở chuột mắc bệnh CKD tiến triển. Ngoài ra, sự suy giảm 1α,25(OH)2D3 làm tăng sản xuất PTH, hoạt động kết hợp với FGF23 để kích thích phosphat niệu. Từ đó các phương pháp điều trị để ngăn ngừa sự gia tăng FGF23 có thể trở thành trọng tâm điều trị ban đầu. Điều trị bằng paracalcitol làm tăng thêm FGF23 trong bệnh thận mạn giai đoạn cuối. Vì calcitriol làm tăng FGF23, các liệu pháp làm giảm calcitriol có thể được áp dụng, chẳng hạn như paracalcitol liều thấp kết hợp và calcimimetics, cho thấy làm giảm được nồng độ FGF23 ở bệnh nhân bệnh thận giai đoạn cuối.
Còn có những lỗ hổng quan trọng trong kiến thức của chúng ta về chức năng của FGF23 trong CKD. Chúng ta vẫn chưa biết cơ chế kháng của cơ quan đích đối với FGF23 do mất chức năng FGFR và / hoặc sự hiện diện của CKD dẫn đến tăng sản xuất FGF23 trong xương và liệu sự điều hòa FGF23 này có đại diện cho một vòng phản hồi giữa thận và xương hay không. Các con đường mới để điều hòa chọn lọc các sản phẩm gen bằng FGFR3, -4 và -1 (tức là, kiểm soát chọn lọc các sản phẩm gen bằng các FGFR khác nhau có thể phân tách sự điều hòa vận chuyển photphat từ chuyển hóa vitamin D cũng như các chức năng khác) vẫn chưa được khám phá đầy đủ.
4.4.2. Mối liên quan giữa FGF23 Tăng cao và Tỷ lệ tử vong
Khi CKD tiến triển thành bệnh thận mạn giai đoạn cuối, sự gia tăng tiến triển của FGF23 trở nên không thích hợp, có thể góp phần làm suy thận tiến triển nhanh hơn, rối loạn chức năng tim, và vôi hóa mạch máu góp phần gây ra bệnh tật và tang tỉ lệ tử vong. Phân tích các nhóm thuần tập bị suy thận giai đoạn cuối cho thấy FGF23 tăng có liên quan đến tăng tỷ lệ tử vong, không phụ thuộc vào nồng độ phosphat huyết thanh. FGF23 tăng cao có thể có những tác động đến tỷ lệ tử vong và bệnh lý tim mạch ở những bệnh nhân không mắc bệnh thận giai đoạn cuối. FGF23 tăng có liên quan đến bệnh tim mạch / tử vong ở bệnh nhân cao tuổi có “chức năng thận bình thường” và ở bệnh nhân CKD tiến triển. FGF23 cũng có mối liên quan giữa tái tạo xương thấp và vôi hóa tim mạch, vì biểu hiện osteocalcin thấp, như một dấu hiệu của sự luân chuyển xương, có liên quan đến FGF23 cao và tỷ lệ tử vong do tim mạch. Ngoài ra, có mối liên quan giữa tăng FGF23 với tăng huyết áp và phì đại tim ở bệnh nhân XLH. Cũng có mối liên quan giữa tăng FGF23 với sự tiến triển của xơ hóa thận trong bệnh thận mạn.
Cơ chế tác động độc hại của FGF23 chưa rõ ràng. Mối liên quan giữa FGF23 tăng và tỷ lệ tử vong tăng không phụ thuộc vào nồng độ phosphat trong bệnh thận mạn giai đoạn cuối, cho thấy các yếu tố khác có liên quan. Hiện nay, vẫn chưa rõ liệu các tác động của FGF23 có phải là trung gian của việc ức chế hoạt động Klotho của thận hoặc các yếu tố có nguồn gốc từ thận được điều chỉnh bởi FGF23 khác hay do tác động ngoài mục tiêu của mức FGF23 rất cao được tìm thấy ở CKD. Có nhiều bằng chứng mới cho thấy FGF23 ngăn chặn tác động lên thận của ACE2, mà không giống như ACE, tạo ra các peptide, chẳng hạn như angiotensin, có giãn mạch và natriuretic hiệu ứng để làm giảm huyết áp. FGF23 điều chỉnh midkine, một yếu tố có liên quan đến tăng hoạt động của ACE và tăng huyết áp ở CKD. Do đó, dư thừa FGF23 có thể ảnh hưởng đến hệ thống tim mạch bằng cách ức chế Klotho hoặc bằng cách tăng cường hệ thống renin-angiotensin (RAS) thông qua nhiều cơ chế.
4.4.3. TIO (Tumor Induced Osteomalasia)
TIO (Khối u gây ra nhuyễn xương) là một rối loạn paraneoplastic mắc phải, đặc trưng bởi giảm phosphat huyết, nhuyễn xương và rối loạn chuyển hóa vitamin D, tương tự như rối loạn giảm phosphat máu di truyền, nhưng gây ra bởi sự tăng sản xuất FGF23 bởi các khối u lành tính. FGF23 được bài tiết từ các khối u gây nhuyễn xương, giảm phosphat huyết, và việc loại bỏ các khối u sẽ làm giảm mức FGF23. Nồng độ FGF23 huyết thanh rất hữu ích để chẩn đoán TIO ở những bệnh nhân bị giảm phosphat máu không rõ nguyên nhân, và quét octreotide sestabmibi có thể hữu ích trong việc xác định vị trí của khối u trung mô lành tính ẩn tiết ra FGF23.
4.4.4. Tác dụng điều trị bằng thuốc
Trục thận - xương - FGF23 đưa ra những giải thích mới cho tình trạng giảm phosphat máu và tăng phosphat máu được quan sát thấy ở một số cơ sở lâm sàng khác. Có một số loại thuốc gây tăng hoặc giảm phosphat máu thông qua việc điều chỉnh tác động của FGF23. Chúng bao gồm các chất ức chế FGFR kinase đang được phát triển cho các liệu pháp điều trị ung thư được báo cáo là dẫn đến tăng phosphat trong máu, các chế phẩm sắt tiêm vào tĩnh mạch được sử dụng để điều trị thiếu máu và glucocorticoid gây giảm phosphat máu. Cơ chế của những tác dụng này chưa được rõ ràng, nhưng tác động của việc sử dụng sắt đường tiêm đã gây giảm phosphat máu do tăng FGF23 có thể tác động qua trung gian bằng sự ức chế Phex và / hoặc khoáng hóa xương. Tác dụng của các chất ức chế thụ thể tyrosine kinase có thể là do chúng ngăn chặn các tác động lên cơ quan đích của FGF23. Ngoài ra, prednisone có liên quan đến tăng FGF23 cũng như quá trình tiêu xương, có thể cung cấp thêm bằng chứng về mối liên hệ giữa quá trình khoáng hóa xương và hoạt hóa FGF23.
5. Kết luận
Việc phát hiện ra FGF23 đã thay đổi hiểu biết của chúng ta về quá trình chuyển hóa khoáng bằng cách xác định các vòng phản hồi nội tiết và tác động chéo phức tạp hơn giữa tuyến cận giáp, ruột, xương và thận để duy trì cân bằng nội môi, chuyển hóa năng lượng và sức khỏe của xương. Sự hiểu biết đầy đủ về các chức năng tích hợp của các mạng lưới nội tiết tố này vẫn đang được làm sáng tỏ, nhưng tầm quan trọng của FGF23 được biết với những tác động sâu sắc của sự dư thừa hoặc thiếu hụt của nó đối với cân bằng nội môi và sự kết hợp của nhiều yếu tố tại chỗ và hệ thống để điều chỉnh hoạt động của FGF23 tại mức độ của tế bào xương trong xương. Các chức năng chính của FGF23 tác động toàn thân của nó là:
- Hoạt động như một hormon phản điều hòa đối với 1α,25(OH)2D3.
- Phối hợp xử lý phosphat ở thận để phù hợp với quá trình khoáng hóa xương.
Bằng chứng rõ ràng ủng hộ vai trò chính của FGF23 trong việc điều hòa chuyển hóa vitamin D bao gồm điều chỉnh 1α,25(OH)2D3, hoạt động của FGF23 trong xương và tác động chi phối FGF23 để điều chỉnh mức 1α,25(OH)2D3 ở trạng thái thừa và thiếu FGF23. Bằng chứng cho sự kết hợp giữa quá trình khoáng hóa và FGF23 là gián tiếp, nhưng được gợi ý bởi ảnh hưởng của sự thiếu hụt Dmp1 hoặc Phex đến việc tăng sản xuất FGF23 bởi các tế bào xương trong ARHR và XLH thông qua các yếu tố nền cục bộ cũng như các thay đổi liên kết dữ liệu khác trong chu chuyển xương và thông lượng phosphat với những thay đổi trong FGF23. Sự kết hợp này có thể điều chỉnh sự bài tiết phosphat qua thận để phù hợp với tốc độ lắng đọng phosphat vào xương khác nhau. Có khả năng nhiều yếu tố điều chỉnh xương cũng như chuyển hóa năng lượng sẽ được phát hiện cũng điều chỉnh sự hoạt động của FGF23. Cần có những nghiên cứu sâu hơn để hiểu cơ chế phân tử theo đó những thay đổi cục bộ trong mô xương và các yếu tố hệ thống điều chỉnh hoạt động của FGF23 trong xương.
FGF23 có thể có các chức năng bổ sung để điều chỉnh chức năng PTH, nhưng không chắc liệu FGF23 có ức chế hoặc kích thích chức năng PTG thông qua các phức hợp FGFR / Klotho trong PTH hay không. Ngoài ra, liệu tác động trực tiếp giả định của PTH để điều chỉnh biểu hiện FGF23 trong xương thông qua kiểm soát phiên mã biểu hiện FGF23 hay gián tiếp do những thay đổi do PTH gây ra trong quá trình tái tạo xương / thông lượng phosphat vẫn còn được xác định. Một trục PTH - xương được đề xuất trong đó PTH kích thích FGF23 và FGF23 ức chế PTH là nghịch lý với những phát hiện rằng PTH không điều chỉnh FGF23 khi không có 1α,25(OH)2D3 và tác động của FGF23 ngăn chặn 1α,25(OH)2D3 và kích thích PTH. Một giả thuyết tích hợp để giải thích những phát hiện khác nhau này cần được phát triển. Tương tự, FGF23 rõ ràng tham gia vào việc điều hòa cân bằng nội môi phosphat, nhưng không giống như sự kết hợp chặt chẽ giữa những thay đổi của calci huyết thanh với sự bài tiết PTH trung gian qua thụ thể calci CasR, mối quan hệ giữa những thay đổi trong phosphat và FGF23 là thay đổi nhiều hơn và có lẽ là gián tiếp. Cơ chế phân tử điều hòa phosphat của FGF23 chưa được biết và có thể liên quan đến tác dụng của phosphate đối với quá trình khoáng hóa xương. Hơn nữa, FGF23 có khả năng có các chức năng bổ sung vẫn chưa được khám phá. Tác động tự nội tiết / nội tiết của FGF23 đối với sự trao đổi chất của xương và các mô khác nơi FGF23 được thể hiện ở mức độ phong phú thấp vẫn chưa được hiểu rõ. Cuối cùng, các chức năng của FGF23 trong não và tuyến yên vẫn chưa được biết,mặc dù thực tế rằng nó là mô đầu tiên FGF23 được xác định. Ngoài ra còn có những khoảng trống đáng kể trong hiểu biết của chúng ta về ảnh hưởng của FGF23 đối với thận. Sự không đồng nhất về chức năng rõ ràng của việc kích hoạt đồng dạng FGFR bởi FGF23, các phân đoạn ống thận nhậy cảm với FGF23 và các sản phẩm gen cụ thể được điều chỉnh bởi FGF23 vẫn chưa được xác định đầy đủ. Cuối cùng, việc phát hiện ra FGF23 đã có tác động lâm sàng đáng kể, bao gồm sự hiểu biết tốt hơn về cách chẩn đoán và điều trị các rối loạn giảm phosphat huyết di truyền và mắc phải, những hiểu biết mới về cơ chế bệnh sinh của rối loạn chuyển hóa khoáng chất trong bệnh thận mạn tính, một khuôn khổ mới để hiểu cơ chế tăng phosphat máu do các loại thuốc khác nhau và cơ chế phân tử liên kết chuyển hóa khoáng chất bị rối loạn với tăng tỷ lệ tử vong do tim mạch. Tuy nhiên,vẫn còn nhiều điều cần được khám phá về ý nghĩa bệnh lý của FGF23 trong các trạng thái bệnh khác nhau, liệu các chiến lược điều trị có nên xem xét các tác động sinh học tiềm ẩn của FGF23 bị thay đổi hay không và liệu bản thân FGF23 có trở thành mục tiêu điều trị thích hợp để tăng cường và / hoặc ức chế chức năng FGF23 ở các cơ sở y tế.