Bệnh cầu thận màng nguyên phát ở người – (Một bí mật mới được giải mã)
Richard J. Glassock, M.D. The new England Journal of Medicine. July 2, 2009
N Engl J Med 2009; 361:81-83
DOI: 10.1056/NEJMe0903343
Chỉ mới hơn 50 năm trước đây, David Jones [1] đã xác định được đặc điểm bệnh lý cầu thận của bệnh cầu thận màng (sử dụng phương pháp nhuộm periodic acid–Schiff and methenamine silver), vì vậy đã phân biệt được nó với các nguyên nhân khác của “viêm cầu thận có hội chứng thận hư”. Nghiên cứu miễn dịch huỳnh quang và kính hiển vi điện tử đã chỉ ra viêm cầu thận màng được đặc trưng bởi lắng đọng dạng hạt của IgG và lắng đọng đặc điện tử dọc theo màng nền cầu thận (hoặc dưới biểu mô). Lắng đọng IgG ở cầu thận ban đầu được tin là do phức hợp miễn dịch hình thành trong tuần hoàn, giống như mẫu viêm cầu thận ở chuột (bệnh huyết thanh mạn tính).
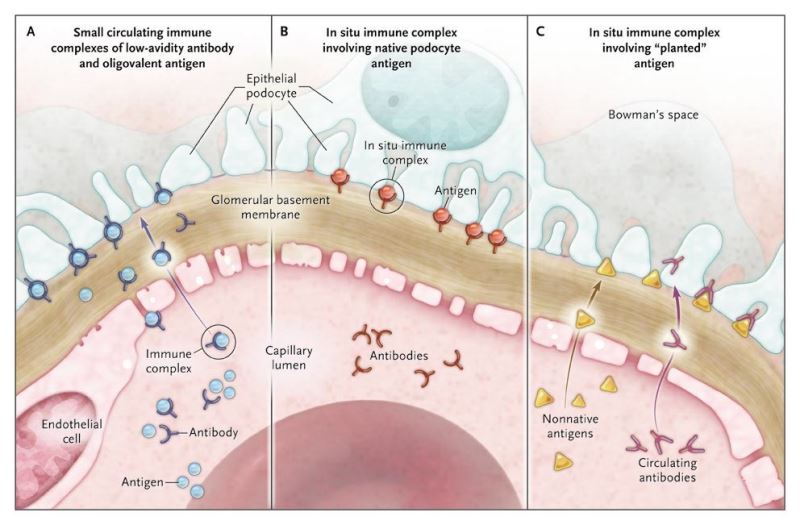
Hình 1. Cơ chế hình thành lắng đọng dưới biểu mô ở mẫu thực nghiệm và ở bệnh nhân viêm cầu thận màng.
Năm 1959, Heymann và cs [2] đã mô tả mẫu viêm cầu thận màng trên chuột, tương tự như bệnh lý ở người sinh ra bởi hoạt động miễn dịch. Ban đầu mẫu này cũng được tin là do lắng đọng từ những phức hợp miễn dịch lưu hành trong tuần hoàn. Tuy nhiên, Van Damme và cộng sự [3] và Couser và cộng sự [4] chứng minh là kháng thể trong tuần hoàn tới và phản ứng với kháng nguyên nguyên phát khu trú trên các tế bào pocyte – các tế bào nội mô mao mạch cầu thận – đã chỉ ra rằng bệnh được gây ra bởi sự hình thành phức hợp miễn dịch tại chỗ. Chẳng bao lâu các tác giả khác cũng chỉ ra rằng các kháng nguyên lưu hành trong tuần hoàn đã tới thận và được “cấy” vào cầu thận (màng nền cầu thận hoặc các tế bào podocyte), mặc dù thành mao mạch cũng có thể bị tổn thương (hình 1).
Cả kháng nguyên đích và tự kháng thể hoạt động trong mẫu thực nghiệm Haymann là đặc trưng. Vì vậy mọi tiên đề của Witebsky [5] được thỏa mãn, xác định tự kháng thể tự nhiên của bệnh ở mẫu thực nghiệm trên chuột.
Tuy nhiên suy diễn từ bệnh sinh của mẫu thực nghiệm trên chuột tới bệnh cầu thận màng nguyên phát ở người là khó. Kháng nguyên đích đáp ứng với mẫu thực nghiệm Haymann không thấy xuất hiện trên thận người. Các nghiên cứu kiểm định về các tự kháng thể kháng lại kháng nguyên “Heymann” (hiện nay được biết là megalin [glucoprotein 330]) không đáng được khích lệ [6]. Vì vậy bệnh sinh thực tế của bệnh viêm cầu thận nguyên phát trên người vẫn chưa được giải quyết. Bây giờ, điều bí mật một thời gian dài đã được giải quyết rõ ràng bởi Beck và cộng sự [7], báo cáo đã được đăng trên tờ báo này. Các tự kháng thể kháng lại kháng nguyên bình thường có ở trên màng tế bào podocyte, đó là phospholipase A2 receptor (PLA2R) týp M, xuất hiện trong tuần hoàn và gắn với cấu trúc quyết định kháng nguyên (hoặc các quyết định kháng nguyên) có mặt trên PLA2R sinh ra lắng đọng đặc trưng tại chỗ trong bệnh cầu thận màng. Các tự kháng thể này có kích thước lớn, nhưng không đặc biệt, chúng là globulin miễn dịch dưới lớp IgG4, các globulin miễn dịch này thấy có mặt trong bệnh viêm cầu thận màng nguyên phát ở bệnh nhân. Các bệnh thận khác và các thể thứ phát của viêm cầu thận màng (như là bệnh viêm cầu thận màng lupus) không thấy xuất hiện các tự kháng thể như vậy. Beck và cộng sự cũng đã chỉ ra sự kết hợp giữa đặc trưng lâm sàng của bệnh (protein niệu và hội chứng thận hư) và sự có mặt của tự kháng thể trong tuần hoàn. Nếu như bệnh có thể được thực nghiệm trên động vật linh trưởng không phải người cái mà biểu lộ kháng nguyên PLA2R trên tế bào podocyte hoặc nếu như các lắng đọng dưới biểu mô có thể xuất hiện trở lại nhanh ở thận ghép của người cho bình thường với người nhận bị viêm cầu thận màng nguyên phát, người mà có sẵn trong tuần hoàn tự kháng thể kháng PLA2R, thì tiên đề của Witebsky [5] sẽ thỏa mãn cho bệnh ở người. Thêm nữa, tự kháng thể kháng PLA2R cần được chứng minh như là vector trong tuần hoàn và PLA2R của tế bào podocyte cần được chứng minh là tự kháng nguyên đích trong bệnh cầu thận màng. Ngay cả khi không có các bằng chứng này thì những quan sát của Beck và cs cũng biểu trưng cho một khám phá chính, cái mà mở đầu cho một kỷ nguyên mới trong nghiên cứu về bệnh cầu thận màng ở người. Tuy nhiên vẫn còn một vài điều bí ẩn nữa cần được giải quyết. Thứ nhất, còn một tỉ lệ các trường hợp cái mà chúng ta gọi là viêm cầu thận màng “nguyên phát” có phải là nguyên nhân do tự kháng thể kháng PLA2R không? Tiếp đến cái gì khởi phát sinh ra các tự kháng thể này? thứ ba bằng cách nào các tự kháng thể này sinh ra được thấm qua cầu thận tới protein?
Beck và cs báo cáo rằng có 70% bệnh nhân viêm cầu thận màng là do kháng thể kháng PLA2R [7]. Các quan sát trước đây cũng gợi ý rằng nhiều bệnh nhân bị bệnh cầu thận màng nguyên phát cũng có tự kháng thể trong tuần hoàn phản ứng với endopeptidase trung tính. Các kháng nguyên podocyte khác nữa cũng liên quan với bệnh cầu thận màng bẩm sinh [8] [9]. Điều này đòi hỏi cần chia sẻ các mẫu huyết thanh giữa các labo nghiên cứu bệnh cầu thận màng và xác định độc lập ở các quần thể khác nữa về các bệnh nhân viêm cầu thận màng nguyên phát với việc sử dụng cả kháng thể kháng PLA2R và kháng thể kháng endopeptidase trung tính bằng các thử nghiệm ngẫu nhiên. Thêm nữa các quan sát trước đây còn cho thấy vai trò của tự kháng thể kháng α-enolase thấy ở các bệnh nhân người Nhật cần được khám nghiệm lại [10]. Sự khác nhau của các tự kháng thể thấy ở các bệnh nhân bị bệnh cầu thận màng nguyên phát có thể là một dải rộng các kháng nguyên, như là các quan sát ở các bệnh tự miễn mạn tính khác [11]. Khám nghiệm một loạt các mẫu huyết thanh thu được tích trữ qua các năm trước khi bệnh cầu thận màng khởi phát và được chẩn đoán rõ cần được làm sáng tỏ trong lý thuyết này [12].
Hiểu rõ hơn về một cơ quan tiềm tàng hoặc yếu tố môi trường khởi phát sản sinh tự kháng thể ở bệnh nhân bị viêm cầu thận màng nguyên phát có thể mở ra khả năng phòng bệnh. Việc gắn các tự kháng thể với các kháng nguyên tương ứng của nó trên bề mặt của tế bào podocyte có khả năng khởi phát quá trình bệnh. Tuy nhiên nhiều số liệu từ thực nghiệm và nghiên cứu lâm sàng gợi ý rằng hoạt động tại chỗ của thác bổ thể và nói chung của phức hợp bổ thể tấn công màng ở thành mao mạch đóng vai trò quan trọng gây tổn thương tính thấm của cầu thận dẫn tới protein niệu. Điều này có vẻ như là điều tiến thoái lưỡng nan, vì globulin dưới nhóm IgG4 được biết là gây hoạt hóa bổ thể rất yếu. Nếu chỉ các tự kháng thể trong tuần hoàn và tại các lắng đọng là dưới nhóm IgG4 thì chẳng gây được gì. Có lẽ các sản phẩm đi kèm như tự kháng thể IgG1 hoặc IgG2 đòi hỏi cho sự bộc lộ đầy đủ về sự bất thường tính thấm của cầu thận.
Thêm nữa, các nghiên cứu sẽ trả lời cho những vấn đề rắc rối này. Ngoài ra, dường như là các quan sát của Beck và cs sẽ có hiệu quả trên lâm sàng để chẩn đoán và điều trị bệnh cầu thận màng. Các xét nghiệm kháng thể kháng PLA2R (và có lẽ cả kháng thể kháng endopeptidase nữa) có thể cho phép chẩn đoán không xâm nhập bệnh cầu thận màng cũng như cung cấp một phương pháp tiện lợi để theo dõi hoạt động của bệnh đáp ứng với điều trị. 5 thập kỷ sau khi nhận diện được bệnh viêm cầu thận màng thì ngày nay đã có thể đi vào một kỷ nguyên mới.
Tài liệu tham khảo:
1. Jones DB. Nephrotic glomerulonephritis. Am J Pathol 1957;33:313-329
2. Heymann W, Hackel DB, Harwood S, Wilson SG, Hunter HL. Production of nephrotic syndrome in rats by Freund's adjuvant and rat kidney suspensions. Proc Soc Exp Biol Med 1959;100:660-664
3. Van Damme BJ, Fleuren GJ, Bakker WW, Vernier RL, Hoedemaeker PJ. Experimental glomerulonephritis in the rat induced by antibodies directed against tubular antigens. V. Fixed glomerular antigens in the pathogenesis of heterologous immune complex glomerulonephritis. Lab Invest 1978;38:502-510
4. Couser WG, Steinmuller DR, Stilmant MM, Salant DJ, Lowenstein LM. Experimental glomerulonephritis in the isolated perfused rat kidney. J Clin Invest 1978;62:1275-1287
5. Rose NR, Bona C. Defining criteria for autoimmune diseases (Witebsky's postulates revisited). Immunol Today 1993;14:426-430
6. Whitworth JA, Leibowitz S, Kennedy MC, et al. Absence of glomerular renal tubular epithelial antigen in membranous glomerulonephritis. Clin Nephrol 1976;5:159-162
7. Beck LH Jr, Bonegio RGB, Lambeau G, et al. M-type phospholipase A2 receptor as target antigen in idiopathic membranous nephropathy. N Engl J Med 2009;361:11-21
8. Debiec H, Guigonis V, Mougenot B, et al. Antenatal membranous glomerulonephritis due to anti-neutral endopeptidase antibodies. N Engl J Med 2002;346:2053-2060
9. Ronco P, Debiec H. Target antigens and nephritogenic antibodies in membranous nephropathy. Arch Med Sci (in press).
10.Wakui H, Imai H, Komatsuda A, Miura AB. Circulating antibodies against alpha-enolase in patients with primary membranous nephropathy (MN). Clin Exp Immunol 1999;118:445-450
11. Lundberg K, Venables PJ. Epitope spreading in animal models: array of hope in rheumatoid arthritis and multiple sclerosis. Arthritis Res Ther 2008;10:122-123
12.Arbuckle MR, McClain MT, Rubertone MV, et al. Development of autoantibodies before the onset of systemic lupus erythematosus. N Engl J Med 2003;349:1526-1533
Nguồn:
Bài dịch của Hà Hoàng Kiệm từ: Human Idiopathic Membranous Nephropathy — A Mystery Solved? Richard J. Glassock, M.D. The new England Journal of Medicine.
July 2, 2009. N Engl J Med 2009; 361:81-83. DOI: 10.1056/NEJMe0903343