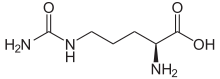
Cấu trúc phân tử Citrulline
PGS.TS. Hà Hoàng Kiệm, BV 103
Mở đầu
Viêm khớp dạng thấp (Rheumatoid Arthritis: RA) là bệnh gặp khá phổ biến ở nước ta, tỉ lệ 0,5-3% dân số là người lớn. Bệnh thường gặp ở tuổi trung niên 40-60 tuổi, nữ chiếm 75%. Người ta chưa biết nguyên nhân, nhưng bệnh sinh đã được xác định là một bệnh tự miễn. Đã có nhiều tổ chức chuyên ngành đưa ra các tiêu chuẩn chẩn đoán, nhưng việc khẳng định bệnh còn là vấn đề khó khăn. Bệnh tiến triển mạn tính dẫn đến biến dạng và mất chức năng khớp. Chưa có thuốc điều trị khỏi hẳn bệnh RA. Gần đây đã có một số tiến bộ trong chẩn đoán và điều trị. Bài viết này sẽ cung cấp cho các bạn một số thông tin về vấn đề này.
Viêm khớp dạng thấp là bệnh khớp mạn tính phổ biến, có cơ chế tự miễn dịch, tổn thương cơ bản tại màng hoạt dịch, bệnh biểu hiện bởi tình trạng khớp viêm mạn tính có xen kẽ các đợt tiến triển. Ngoài các biểu hiện ngoài khớp do có tính chất hệ thống, tỷ lệ tàn phế cao do tình trạng hủy khớp. Hiện nay hầu hết các nước trên thế giới dựa vào tiêu chuẩn của Hội Thấp khớp học Hoa Kỳ ACR 1987 (American College of Rheumatology) để chẩn đoán. Tuy nhiên, hạn chế của tiêu chuẩn này chưa chẩn đoán được bệnh ở giai đoạn sớm, do đó Hội Thấp khớp học Hoa Kỳ kết hợp với Liên đoàn chống Thấp khớp Châu Âu EULAR (European League Against Rhumatism) đang đề nghị ứng dụng tiêu chuẩn ACR/EULAR 2010. Gần đây, một số tự kháng thể như kháng thể kháng CCP (anti cyclic citrullinated peptide antibodies) đã được ứng dụng vào thực tiễn để chẩn đoán và tiên lượng bệnh cùng với với yếu tố dạng thấp RF (Rheumatoid Factor). Các phương pháp chẩn đoán hình ảnh như siêu âm và cộng hưởng từ phát hiện được các loại tổn thương trên ngay ở giai đoạn sớm của bệnh. X quang chỉ phát hiện được các tổn thương xương khớp, đặc biệt là tình trạng viêm màng hoạt dịch, hình ảnh bào mòn xương giúp đánh giá tình trạng bệnh sớm, nhằm quyết định điều trị tích cực. Các thuốc chống thấp khớp kinh điển làm thay đổi bệnh (Disease-modifying antirheumatic drugs DMARDs) như methotrexat, thuốc điều trị sốt rét tổng hợp... có vai trò quan trọng trong việc ổn định bệnh, song chưa đủ để kiểm soát bệnh trong nhiều trường hợp. Với các hiểu biết mới hiện nay về cơ chế bệnh sinh, các thuốc sinh học (kháng TNF, ức chế tế bào B hoặc tế bào T, ức chế các Interleukin...) còn được gọi là thuốc DMARDs sinh học đã được ứng dụng và mang lại kết quả tốt, cải thiện nhanh triệu chứng tại khớp và triệu chứng ngoài khớp trên lâm sàng, thuốc còn có hiệu quả bảo tồn cấu trúc khớp, do vậy bảo tồn chức năng khớp, nâng cao chất lượng cuộc sống của bệnh nhân. Ngoài ra, các phương pháp phục hồi chức năng, chỉnh hình, và công tác quản lý bệnh nhân, giáo dục bệnh nhân hòa hợp với cộng đồng đóng vai trò quan trọng trong điều trị bệnh viêm khớp dạng thấp.
Cơ chế bệnh sinh
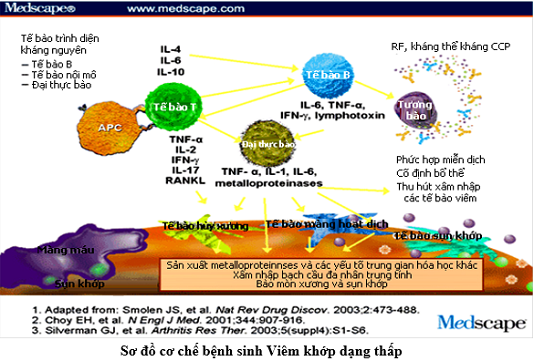
Nguyên nhân gây bệnh viêm khớp dạng thấp chưa rõ, hiện bệnh được coi là một bệnh tự miễn dịch với sự tham gia của nhiều yếu tố như nhiễm khuẩn hoặc di truyền. Kháng nguyên là các tác nhân gây bệnh xâm nhập vào cơ thể gây khởi phát một chuỗi các phản ứng miễn dịch, trong đó các tế bào lympho T đóng vai trò then chốt. Các tế bào lympho T, sau khi tiếp xúc với kháng nguyên, sẽ tập trung nhiều ở các khớp bị ảnh hưởng và giải phóng ra các cytokin. Vai trò của các cytokin này là tác động lên các tế bào khác, trong đó có ba loại tế bào chủ yếu: lympho B, đại thực bào và tế bào nội mô mạch máu màng hoạt dịch. Dưới tác động của các cytokin trên, các tế bào lympho B sẽ sản xuất ra yếu tố dạng thấp có bản chất là các globulin miễn dịch (đa số thuộc nhóm IgG, một số thuộc nhóm IgM), từ đó tạo ra các phức hợp miễn dịch lắng đọng tại màng hoạt dịch khớp và gây tổn thương khớp. Các cytokin cũng hoạt hoá đại thực bào sản xuất ra các cytokin khác gây kích thích các tế bào màng hoạt dịch, tế bào sụn, nguyên bào xơ… tăng sinh, xân lấn vào sụn tạo thành màng máu. Các tế bào trên, đến lượt mình lại giải phóng ra một loạt các enzyme như collagenase, stromelysin, elastase…gây huỷ hoại sụn khớp, xương. Các cytokin do tế bào lympho T tiết ra còn hoạt hoá các tế bào nội mô mao mạch màng hoạt dịch sản xuất ra các phân tử kết dính, thu hút các loại tế bào viêm đến khoang khớp. Các tế bào viêm này đến lượt mình lại giải phóng ra các cytokin khác…Hậu quả của các quá trình này là hình thành màng máu màng hoạt dịch (pannus). Pannus tăng sinh và phì đại, xâm lấn sâu vào đầu xương dưới sụn gây nên các thương tổn thương bào mòn xương (erosion) và hủy khớp, dẫn đến tình trạng dính và biến dạng khớp. Hiện nay, dựa trên sự hiểu biết về cơ chế bệnh, các thuốc điều trị sinh học nhằm vào đích, ức chế từng loại tế bào, từng loại cytokin, do đó được coi là điều trị theo mục tiêu.
Các yếu tố thuận lợi: nhiễm khuẩn (Epstein-Barr virus, Parvo virus... hoặc Mycoplasma, vi khuẩn đường ruột...); cơ địa (cơ thể suy yếu, chấn thương...), hoặc yếu tố môi trường (lạnh ẩm kéo dài); tuổi, giới (trên 40; nữ); tính chất gia đình, HLA- DR4...
1. Tiến bộ trong chẩn đoán
1.1. Xét nghiệm
+ Yếu tố dạng thấp RF (Rheumatoid Factor) huyết thanh: trước kia được gọi là phản ứng Waaler- Rose do mang tên hai tác giả đã phát hiện ra yếu tố dạng thấp bằng phản ứng ngưng kết hồng cầu cừu, hoặc phản ứng gama latex khi thay hồng cừu bằng các hạt nhựa latex. Hiện nay RF được định lượng bằng phương pháp đo độ đục, với nồng độ trên 14 IU/ml được coi là dương tính- là một trong bảy yếu tố thuộc tiêu chuẩn chẩn đoán do Hội Thấp khớp học Mỹ (American College of Rheumatology- ACR) đề nghị năm 1987. Các kết quả nghiên cứu tại Việt nam cho thấy RF có độ nhạy dao động 80%; độ đặc hiệu khoảng 88% và giá trị tiên đoán dương là 90%; giá trị tiên đoán âm là 80%. Việc định lượng được yếu tố dạng thấp cho phép tiên lượng, đặc biệt khi kết hợp với kháng thể kháng CCP.
+ Kháng thể kháng CCP (anti-CCP): Đây là một phát hiện mới vào giữa năm 1970, khi người ta nghiên cứu phản ứng kháng thể chống lại keratin và filaggrin, Các nghiên cứu cho thấy kháng thể trong máu bệnh nhân bị RA phản ứng với một loạt các kháng nguyên citrulline khác nhau. Xét nghiệm này nhanh chóng được ứng dụng vào lâm sàng, giá trị của xét nghiệm kháng thể này là xuất hiện sớm, thậm chí trước khi có viêm khớp, và có giá trị tiên lượng viêm khớp dạng thấp. Với một bệnh nhân tại giai đoạn chưa đủ tiêu chuẩn xác định bệnh, sự có mặt đồng thời cả RF và Anti-CCP giúp tiên lượng về sự biểu hiện thành một viêm khớp dạng thấp thực sự trong tương lai. Xét nghiệm Anti-CCP và RF có độ nhạy tương tự nhau, song những xét nghiệm anti-CCP có độ đặc hiệu cao (98% so với 88%). Đặc biệt, sự có mặt của cả hai tự kháng thể này cho thấy bệnh nhân có nguy cơ xuất hiện tổn thương bào mòn xương trên X-quang khớp cổ bàn tay sớm và trầm trọng, bệnh diễn biến dai dẳng, không có đợt thuyên giảm, nhiều đợt tiến triển.
Xét nghiệm Anti - CCP Cyclic (Cyclic Citrullinated Peptide Antibody)
Tên khác: CCP Antibody; Citrulline Antibody; Anti-citrulline Antibody; Anti-cyclic Citrullinated Peptide; Anti-CCP; ACPA
Tên chính: Cyclic Citrullinated Peptide Antibody
Xét nghiệm liên quan: Yếu tố thấp (Rheumatoid Factor-RF), Tốc độ lắng máu (erythrocyte sedimentation rate - ESR), protein phản ứng C (CRP), Kháng thể kháng nhân (Antinuclear Antibody), Xét nghiệm dịch khớp (Synovial Fluid Analysis).
Kháng thể CCP (Anti-CCP) là tự kháng thể được sản xuất bởi hệ thống miễn dịch trực tiếp chống lại peptide citrullinated vòng. Citrulline được sản xuất tự nhiên trong cơ thể trong quá trình chuyển hóa, nó là một chất trung gian trong chuỗi phản ứng chuyển hóa của acid amin arginine. Tuy nhiên, trong một số protein, việc chuyển đổi từ arginine thành citrulline sản xuất các cấu trúc trung gian tạo thành một vòng tuần hoàn được gọi là peptide citrullinated. Do rối loạn miễn dịch, cơ thể sản xuất ra kháng thể kháng CCP thường xảy ra ở những người bị bệnh RA. Người ta cho rằng sự hình thành anti-CCP có thể đóng một vai trò trong quá trình viêm tự miễn xảy ra trong các khớp của những người có bệnh RA. Các xét nghiệm phát hiện kháng thể kháng CCP và các đo lường kháng thể kháng CCP trong máu giúp cho chẩn đoán bệnh RA.
Yếu tố dạng thấp (RF) là xét nghiệm máu chính được sử dụng để phát hiện bệnh RA và phân biệt nó với các loại viêm khớp do quá trình viêm khác. Tuy nhiên RF chỉ thấy dương tính ở khoảng 70% số bệnh nhân RA, độ nhạy và độ đặc hiệu của RF không cao. Các nghiên cứu đã chỉ ra rằng các xét nghiệm kháng thể kháng CCP có độ nhạy và độ đặc hiệu là bằng hoặc tốt hơn so với RF và có nhiều khả năng dương tính với RA sớm.
Năm 2010, tiêu chí phân loại viêm dạng khớp của Trường cao đẳng Thấp khớp Mỹ (ACR) bao gồm các xét nghiệm kháng thể kháng ACC, cùng với RF, như là một phần của tiêu chí để chẩn đoán viêm khớp dạng thấp. Theo ACR, kháng thể kháng ACC có thể được phát hiện trong khoảng 50-60% những người có RA sớm, sớm nhất là 3-6 tháng sau khi bắt đầu có triệu chứng. Phát hiện và chẩn đoán bệnh RA sớm cho phép các bác sĩ bắt đầu điều trị tích cực tình trạng này, giảm thiểu các biến chứng kèm theo và tổn thương mô.
Xét nghiệm kháng thể CCP có thể được chỉ định cùng với hoặc sau xét nghiệm yếu tố dạng thấp (RF) để giúp chẩn đoán bệnh RA và để đánh giá mức độ nghiêm trọng và tiên lượng bệnh. Kháng thể CCP cũng có thể được chỉ định để giúp đánh giá sự phát hiện sớm RA ở những người bị viêm khớp nhưng chưa đáp ứng tiêu chuẩn của ACR cho bệnh RA. Theo ACR, khoảng 95% những người có kháng thể kháng CCP dương tính sẽ đáp ứng các tiêu chí của RA trong tương lai.
Trước đây, các xét nghiệm chẩn đoán viêm khớp dạng thấp bao gồm yếu tố dạng thấp (rheumatoid factor - RF), protein phản ứng C (C-reactive protein - CRP) và tốc độ máu lắng (erythrocyte sedimentation rate-ESR). Tuy nhiên, RF không hoàn toàn đặc hiệu cho viêm khớp dạng thấp, cũng có thể xuất hiện ở những người già khỏe mạnh hoặc ở những bệnh nhân bị các bệnh tự miễn hoặc nhiễm khuẩn khác; còn CRP và máu lắng là dấu hiệu của phản ứng viêm nói chung.
Gần đây, việc định lượng tự kháng thể IgG kháng peptid citrullin mạch vòng (antibody to cyclic citrullinated peptide - anti-CCP), một kỹ thuật định lượng anti-CCP thế hệ 2 (second-generation anti-CCP assay) trong huyết thanh hoặc huyết tương, đặc hiệu hơn với viêm khớp dạng thấp, đã giúp cho việc chẩn đoán bệnh này hiệu quả hơn. Hiện nay, anti-CCP được định lượng bằng kỹ thuật định lượng miễn dịch hóa phát quang (electrochemiluminescence immunoassay- “ECLIA”) bằng máy phân tích miễn dịch Elecsys – Cobas e.
Chỉ định: Xét nghiệm anti-CCP không được khuyến cáo sử dụng như là một xét nghiệm sàng lọc, nó được chỉ định trong các trường hợp sau:
- Được chỉ định cùng với xét nghiệm RF để giúp chẩn đoán viêm khớp dạng thấp.
- Cũng được chỉ định tiếp sau một xét nghiệm RF (-), nhưng bệnh nhân có các triệu chứng lâm sàng như đau khớp và viêm khớp đối xứng, làm cho người thầy thuốc nghi ngờ bệnh nhân bị viêm khớp dạng thấp.
- Cũng có thể được chỉ định để giúp đánh giá sự tiến triển viêm khớp dạng thấp ở các bệnh nhân viêm khớp không đặc hiệu, có một số triệu chứng lâm sàng gợi ý nhưng không hội đủ các tiêu chuẩn của một viêm khớp dạng thấp.
Giá trị bình thường:
- Giá trị của anti-CCP huyết tương người khỏe mạnh bình thường là dưới 17 U/mL; các giá trị anti-CCP lớn hơn hoặc bằng 17 U/mL được coi là (+).
- Đối với bệnh nhân viêm khớp dạng thấp, với ngưỡng tối ưu (optimal cut-off) của anti-CCP là 17 U/mL, độ nhạy của xét nghiệm là 67,4 % và độ đặc hiệu là 97,0 %.
Ý nghĩa lâm sàng
Về nguyên tắc, các kết quả thu được cần phải được đánh giá trong sự kết hợp với các triệu chứng lâm sàng.
- Nếu cả anti-CCP (+) và RF (+), bệnh nhân nhiều khả năng bị viêm khớp dạng thấp và có thể bệnh đang tiến triến nặng hơn.
- Nếu anti-CCP (+) nhưng RF (-) và các triệu chứng lâm sàng thể hiện bị viêm khớp dạng thấp, bệnh nhân có thể bị viêm khớp dạng thấp giai đoạn sớm hoặc viêm khớp dạng thấp sẽ tiến triển trong tương lai. Theo một nghiên cứu ở Hoa Kỳ, khoảng 95% các bệnh nhân có anti-CCP (+) tính sẽ tiến triển thành viêm khớp dạng thấp trong tương lai.
- Nếu anti-CCP (-) tính nhưng RF (+) tính và các triệu chứng lâm sàng thể hiện bị viêm khớp dạng thấp, bệnh nhân có thể bị viêm khớp dạng thấp hoặc bị một số các viêm khác.
- Nếu cả anti-CCP và RF đều (-), ít có khả năng bệnh nhân bị viêm khớp dạng thấp. Tuy nhiên, cần nhấn mạnh rằng, việc chẩn đoán viêm khớp dạng thấp chủ yếu dựa vào lâm sàng, do đó viêm khớp dạng thấp có thể được chẩn đoán với các triệu chứng lâm sàng điển hình ngay cả khi các kháng thể tự miễn (-) tính.
Một điều cần chú ý nữa là xét nghiệm kháng thể CCP là tương đối mới, nó ngày càng được sử dụng rộng rãi. Kháng thể CCP hiếm khi được tìm thấy trong tình trạng tự miễn khác như bệnh lupus, bệnh Graves và hội chứng Sjogren, và hiếm khi có thể được phát hiện trong nhiễm siêu vi như viêm gan C. Khi kết hợp giữa các xét nghiệm chẩn đoán viêm khớp dạng thấp như anti-CCA, RF, máu lắng và CRP trong chẩn đoán, ở những bệnh nhân đã được chẩn đoán viêm khớp dạng thấp, các xét nghiệm anti-CCP và RF (đã (+) tính) không cần làm lại nữa. Để theo dõi sự tiến triển của viêm khớp dạng thấp và đánh giá hiệu quả điều trị, chỉ cần theo dõi máu lắng và CRP theo thời gian là đủ.
1.2.Chẩn đoán hình ảnh:
Các phương pháp chẩn đoán hình ảnh được áp dụng để đánh giá các tổn thương khớp trong bệnh viêm khớp dạng thấp trước kia chỉ sử dụng X quang quy ước, song khi xuất hiện tổn thương thường đã ở giai đoạn muộn. Hình ảnh bào mòn xương (erosion) được coi là hình ảnh đặc trưng của bệnh, và là một trong tiêu chuẩn chẩn đoán ACR 1987.
Hiện nay, với sự phát triển của kỹ thuật, siêu âm, chụp cộng hưởng từ khớp tổn thương, giúp phát hiện được các tổn thương ở giai đoạn sớm, đặc biệt đánh giá được cả mức độ viêm màng hoạt dịch.
- Chụp cộng hưởng từ khớp tổn thương: Ngoài hình ảnh bào mòn, cộng hưởng từ còn phát hiện đượng hiện tượng phù xương do hiện tượng viêm màng hoạt dịch gây xung huyết từng vùng của xương và sự xâm nhập của dịch rỉ viêm.
- Siêu âm khớp tổn thương với đầu dò tần số thấp (từ 5 - 10 MHz): Siêu âm phát hiện dễ dàng tình trạng viêm màng hoạt dịch, dịch khớp (trong đợt tiến triển) và hình ảnh bào mòn xương sớm và chính xác.
- Nội soi khớp tổn thương: Hiện sử dụng nhiều nhất với khớp gối. Ngoài khả năng chẩn đoán, (đặc biệt có vai trò quan trọng trong viêm khớp dạng thấp thể một khớp) qua hình ảnh nội soi và mô bệnh học, đánh giá tổn thương (mức độ viêm màng hoạt dịch, mức độ hủy sụn, tổn thương dây chằng...) nội soi còn là một biện pháp điều trị qua việc loại bỏ các yếu tố viêm tại chỗ, các mảnh sụn, mảnh tổ chức hoại tử.
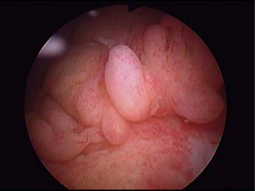
Hình ảnh nội soi khớp gối cho thấy tăng sinh màng hoạt dịch khớp
1.3. Chẩn đoán xác định bệnh viêm khớp dạng thấp có gì mới
- Tiêu chuẩn của Hội Thấp khớp học Mỹ ACR–1987 hiện nay vẫn được ứng dụng rộng rãi trên phạm vi toàn thế giới, cụ thể như sau:
1. Thời gian cứng khớp buổi sáng kéo dài trên một giờ.
2. Viêm ít nhất 3 trong số 14 khớp sau: ngón gần, bàn ngón tay, cổ tay, khuỷu, gối, cổ chân, bàn ngón chân (hai bên), thời gian diễn biến ít nhất phải 6 tuần.
3. Trong số khớp viêm có ít nhất một khớp thuộc các vị trí sau: ngón gần, bàn ngón tay, cổ tay.
4. Có tính chất đối xứng.
5. Hạt dưới da.
6. Yếu tố dạng thấp huyết thanh (Kĩ thuật đạt độ đặc hiệu 95%) dương tính.
7. X-quang điển hình ở khối xương cổ tay (hình ảnh bào mòn, mất chất khoáng đầu xương).
Chẩn đoán xác định khi có ít nhất 4 trong số 7 yếu tố và thời thời gian diễn biến của viêm khớp ít nhất phải 6 tuần.
- Tiêu chuẩn của Hội Thấp khớp học Hoa Kỳ và Liên đoàn chống Thấp khớp Châu Âu 2010 (ACR/EULAR 2010 - American College of Rheumatology/ European League Against Rhumatism): Tiêu chuẩn này có thể tham khảo, áp dụng trường hợp bệnh ở giai đoạn sớm, trước 6 tuần.
A. Khớp tổn thương Điểm
+ 1 khớp lớn: 0
+ 2 - 10 khớp lớn: 1
+ 1 - 3 khớp nhỏ: 2
+ 4 - 10 khớp nhỏ: 3
+ > 10 khớp nhỏ: 5
B. Xét nghiệm miễn dịch (ít nhất phải thực hiện một xét nghiệm)
- Cả RF và Anti CCP âm tính 0
- RF hoặc Anti CCP dương tính thấp 2
- RF hoặc Anti CCP dương tính cao 3
C. Phản ứng viêm cấp tính
- Cả CRP và tốc độ máu lắng bình thường 0
- CRP hoặc tốc độ máu lắng tăng 1
D. Thời gian bị bệnh
+ < 6 tuần 0
+ >= 6 tuần 1
Chẩn đoán viêm khớp dạng thấp khi đạt ≥ 6/10 điểm
Lưu ý
- Khớp lớn bao gồm: Khớp háng, khớp gối, cổ chân, khớp khuỷu, khớp vai
- Khớp nhỏ: Khớp cổ tay, bàn ngón, khớp ngón gần
- Âm tính: RF ≤ 14 UI/ml; Anti CCP ≤17 UI/ml
- Dương tính thấp: Giá trị xét nghiệm ≤3 lần mức bình thường
- Dương tính cao: Giá trị xét nghiệm ≥ 3 lần mức bình thường
1.4. Các thông số đánh giá mức độ hoạt động bệnh viêm khớp dạng thấp
Trước kia, bệnh viêm khớp dạng thấp được đánh giá theo giai đoạn Steinbroker trên cơ sở tình trạng chức năng và hủy hoại khớp. Phân loại này không đáp ứng được mục tiêu điều trị. Mục tiêu hiện nay là kiểm soát được các đợt tiến triển, bảo tồn chức năng khớp, tránh hủy khớp.... Do vậy, xác định mức độ hoạt động trong đó có xác định đợt tiến triển của bệnh viêm khớp dạng thấp nhằm can thiệp tích cực được dựa trên nhiều thông số như VAS, chỉ số Ritchie, chỉ số DAS- 28... được trình bày dưới đây.
Các tiêu chuẩn chẩn đoán đợt tiến triển của bệnh
- Xác định mức độ đau theo VAS (thang điểm VAS – Visual Analog Scale)
Thang điểm VAS là thang điểm đánh giá cường độ đau theo cảm giác chủ quan của bệnh nhân tại thời điểm nghiên cứu được lượng hóa. Từ 10 đến 40 (mm): đau nhẹ Từ 50 đến 60 (mm): đau vừa Từ 70 đến 100 (mm): đau nặng
- Thời gian cứng khớp buổi sáng: thời gian này càng dài thì mức độ hoạt động của bệnh càng nặng. Theo tiêu chuẩn của EULAR thời gian cứng khớp buổi sáng trong đợt tiến triển của bệnh ít nhất phải là 45 phút.
- Số khớp sưng, số khớp đau: càng nhiều khớp sưng đau thì mức độ hoạt động của bệnh càng nặng. Trong đợt tiến triển của bệnh, bệnh nhân sưng ít nhất 3 khớp theo tiêu chuẩn của EULAR.
- Chỉ số Ritchie: Chỉ số này được đánh giá như sau: thầy thuốc dùng đầu ngón tay cái của mình ấn lên trên diện khớp của bệnh nhân với áp lực vừa phải. Tổng cộng có 26 vị trí khớp, cụ thể như sau: có 22 khớp được khảo sát cả hai bên: Khớp vai, khớp khuỷu, khớp cổ tay, khớp bàn ngón tay, khớp ngón gần, khớp háng, khớp gối, khớp cổ chân, khớp sên-gót, khớp bàn cổ chân (khớp sên-hộp), khớp bàn ngón chân (22 vị trí). Các khớp chỉ tính một vị trí, dù khám cả hai bên, có thể đau cả hai bên song chỉ tính điểm một lần: Khớp thái dương hàm, khớp ức đòn, khớp mỏm cùng vai cột sống cổ (04 vị trí). Như vậy, tổng cộng có 26 vị trí khớp được tính điểm. Tùy theo mức độ đau mà tại mỗi vị trí khớp được tính điểm như sau:
0 điểm - không đau
1 điểm - Đau ít, bệnh nhân kêu đau.
2 điểm - Đau vừa, bệnh nhân kêu đau và nhăn mặt.
3 điểm - Đau nhiều, đến nỗi bệnh nhân rút chi lại.
Chỉ số Ritchie từ 0 đến tối đa là 78 điểm. Trong đợt tiến triển của bệnh, chỉ số Ritchie từ 9 điểm trở lên (theo tiêu chuẩn của EULAR).
- Tình trạng viêm trên xét nghiệm: tốc độ máu lắng, protein C phản ứng (CRP) tăng cao trong đợt tiến triển.
Trên cơ sở các thông số trên, có hai loại tiêu chuẩn đánh giá đợt tiến triển thường được sử dụng nhiều nhất trên lâm sàng. Đó là tiêu chuẩn theo EULAR và theo DAS.
Tiêu chuẩn đánh giá đợt tiến triển của bệnh viêm khớp dạng thấp theo EULAR
Có ít nhất ba khớp sưng và ít nhất một ba tiêu chí sau:
• Chỉ số Ritchie từ 9 điểm trở lên.
• Thời gian cứng khớp buổi sáng kéo dài từ 45 phút trở lên
• Tốc độ máu lắng giờ đầu từ 28 mm trở lên
- Điểm mức độ hoạt động của bệnh theo DAS 28 (DAS: Disease activity score)
Thang điểm DAS đánh giá mức độ hoạt động bệnh đã được biết đến từ năm 1983 trong một thử nghiệm lâm sàng của Van Riel và áp dụng phổ biến từ những năm 90. Đây là một công thức toán học được đánh giá dựa trên các biến số: số khớp sưng, số khớp đau, tốc độ máu lắng giờ đầu, điểm VAS, chỉ số Ritchie. Với mỗi biến số đứng độc lập cũng có thể phản ánh phần nào mức độ hoạt động bệnh, khi cùng phối hợp với nhau để đánh giá mức độ hoạt động bệnh thì sẽ cho kết quả chính xác hơn. Đã có nhiều công thức được áp dụng. Ban đầu công thức DAS cổ điển (3 hoặc 4 biến) đếm số lượng khớp sưng đau trên tổng số 44 khớp, bao gồm các khớp chi trên và chi dưới. Sau này Prevoo và cộng sự (1995) đã sử dụng 28 khớp bao gồm các khớp chi trên và 2 khớp gối trong nghiên cứu của ông để đánh giá mức độ hoạt động bệnh thay thế cho 44 khớp đã sử dụng trước đó. Đây cũng là những khớp thường bị tổn thương. Công thức DAS 28 (khảo sát với 28 khớp) hiện được sử dụng phổ biến trên thế giới nhằm đánh giá mức độ hoạt động bệnh trong bệnh viêm khớp dạng thấp. Nhiều nghiên cứu cũng cho thấy DAS 28 có giá trị dự báo mức độ tàn tật và tổn thương X-quang tốt hơn so với DAS cổ điển. Để tính chỉ số DAS 28, ngoài tính trạng sưng và đau của khớp, các thông số cần khảo sát là điểm số VAS, chỉ số tốc độ máu lắng giờ đầu hoặc CRP.
Trên thực tế, chỉ cần gõ vào trang www.4s-dawn.com/DAS28/DAS28.html hoặc gõ DAS 28 sẽ chọn được trang nêu trên; sau khi điền đủ các thông số của bệnh nhân cụ thể theo yêu cầu sẽ có được chỉ số DAS 28 của bệnh nhân đó. Đánh giá mức độ hoạt động của bệnh như sau:
DAS 28 < 2,9 Bệnh không hoạt động
2,9 ≤ DAS 28 < 3,2 Hoạt động bệnh mức độ nhẹ
3,2 ≤ DAS 28 ≤ 5,1 Hoạt động bệnh mức độ trung bình
DAS 28 >5,1 Bệnh hoạt động mạn
2. Tiến bộ trong điều trị
Cho đến hiện nay chúng ta chưa điều trị khỏi được bệnh RA, mục tiêu điều trị là làm giảm triệu chứng, làm chậm tiến triển của bệnh, hạn chế tổn thương xương khớp và phục hồi chức năng khớp. Có nhiều biện pháp điều trị đã được áp dụng bao gồm dùng thuốc và không dùng thuốc, cần phối hợp thuốc và phối hợp các biện pháp dùng thuốc và không dùng thuốc để đạt hiệu quả cao và giảm thiểu các biến chứng.
- Các thuốc điều trị kinh điển:
+ Điều trị triệu chứng
Bao gồm các thuốc giảm đau và kháng viêm không steroid và glucocorticoid. Các thuốc này không có tác dụng bảo vệ cấu trúc của khớp.
* Thuốc giảm đau: tùy mức độ đau của bệnh nhân mà chọn thuốc phù hợp
Paracetamol: liều từ 1,5 - 3g/ngày, chia từ 3 - 4 lần/ngày.
Tramadol
Paracetamol + Codein hoặc + Tramadol hoặc + Dextropropoxyphene.
* Thuốc kháng viêm không steroid (NSAIDs)
Các NSAIDs có tác dụng như nhau, đáp ứng thay đổi tùy bệnh nhân. Cần lưu ý các tác dụng phụ trên đường tiêu hoá và chức năng thận.
Các NSAIDs ức chế COX-2 không dùng trên bệnh nhân có tiền căn bệnh cơ tim thiếu áu và tai biến mạch máu não. Nguy cơ mắc các biến chứng tim mạch cũng xảy ra với các NSAIDs cổ điển nếu dùng kéo dài.
Thận trọng khi dùng ở những bệnh nhân lớn tuổi vì độc tính của thuốc trên hệ tiêu hoá, thận và tim mạch.
Không dùng chung với thuốc kháng vitamin K.
+ Glucocorticoid
Dùng đường truyền tĩnh mạch hoặc đường uống, chỉ dùng nhóm prednisone, prednisolone hoặc methylprednisolone.
* Liều thấp: Prednisone <7,5 mg/ngày
* Liều trung bình: Prednisone từ 7,5 – 30 mg/ngày.
* Liều cao: Prednisone >30mg/ngày.
Điều trị với glucocorticoid gây tăng các nguy cơ vữa xơ động mạch, loãng xương, suy tuyến thượng thận, teo cơ, tăng nguy cơ biến chứng trên đường tiêu hoá trên khi dùng phối hợp với NSAIDs. Bản thân bệnh nhân mắc bệnh VKDT đã có sẵn nguy cơ mắc bệnh loãng xương và bệnh tim mạch. Vì vậy, cần chú ý tầm soát và quản lý thích hợp khi mắc các bệnh này.
Không có một quy trình chung khi cần giảm liều glucocorticoid cũng như việc cai thuốc là rất khó khăn. Vì vậy, cần chỉ định sử dụng thuốc đường toàn thân trong thời gian ngắn nhất và ở liều thấp nhất có thể mà bệnh nhân đáp ứng được.
Chỉ định tiêm corticoid tại khớp khi còn 1-2 khớp không đáp ứng với điều trị.
- Điều trị căn bản
Gồm các thuốc có tác dụng thay đổi diễn tiến của bệnh (DMARDs: Didease - Modifying Anti- Rheumatic Drugs).
+ DMARDs cổ điển:
Thường bắt đầu có tác dụng sau 8-12 tuần.
* Methotrexate (MTX) 2,5 mg: là thuốc được lựa chọn đầu tay. Liều dùng tối đa là 0,3 mg/kg. Liều trung bình: 10 mg uống 1 lần/tuần. Acid folic có thể dùng kèm theo với liều tương đương để làm giảm tác dụng phụ của thuốc. Cần tuân thủ nghiêm ngặt lộ trình theo dõi đáp ứng lâm sàng cũng như tác dụng phụ của thuốc, đặc biệt trên hệ huyết học, thận, hô hấp, tiêu hoá và nguy cơ nhiễm trùng.
* Leflunomide: liều dùng uống 100mg/ngày x 3 ngày sau đó giảm liều còn 20 mg/ngày.
* Sulfasalazine 500 mg: 1g x 2 lần/ngày.
* Hydroxychloroquin 400 mg 1v x 2 lần/ngày.
+ DMARDS sinh học (thuốc mới):
Nhờ những hiểu biết gần đây về cơ chế bệnh sinh của bệnh RA, trong đó có vai trò quan trọng của các cytokin viêm như TNF-alpha, Interleukin-1, Interleukin-6… Người ta đã có các thuốc mới để điều trị được gọi là phương pháp điều trị sinh học (Biological Therapy; Biotherapy). Trên cơ sở sự hiểu biết về cơ chế bệnh sinh của bệnh, về chức năng của mỗi tế bào, mỗi cytokine mà hiện nay các thuốc điều trị sinh học đã tạo ra cuộc cách mạng trong việc điều trị bệnh viêm khớp dạng thấp nhờ hiệu quả cao, tác dụng nhanh, và dung nạp tốt. Nhóm thuốc này bao gồm các tác nhân gây chẹn hoặc tương tác với các chức năng của các cytokines hoạt động trong cơ chế bệnh sinh của bệnh RA. Từ năm 2009, một số thuốc thuộc nhóm này đã được sử dụng tại Việt Nam. Ngoài cải thiện triệu chứng tại khớp và triệu chứng ngoài khớp trên lâm sàng, thuốc còn hạn chế tổn thương trên X-quang (so với các thuốc điều trị cơ bản kinh điển như methotrexat), hạn chế hủy khớp, bảo tồn chức năng khớp. Do thuốc giúp kiểm soát tốt bệnh, nên ngay cả các bệnh nhân đã sử dụng corticoid dài ngày cũng có thể ngừng hẳn hoặc giảm liều corticoid. Thuộc nhóm này có các thuốc ức chế hoặc kháng TNF-alpha (còn được gọi là ức chế yếu tố hoại tử khối u), thuốc ức chế tế bào B hoặc T như Mycophenolat mofetil (CellCept®) hoặc thuốc ức chế tế bào B (B-cell depletion) như Rituximab (MabThera®, Rituxan ®); ức chế các interleukin-1 như Anakinra, Rilonacept, Interleukin-6 như tocilizumab (Actemra®).
* Thuốc ức chế cạnh tranh yếu tố hoại tử u (Anti-TNFa): Etanercept (Enbrel), Infliximab, Adalimunab.
* Thuốc ức chế tế bào T: Abatacept (Mabthera).
* Thuốc ức chế tế bào B: Rituximab.
* Thuốc ức chế Interleukine 1 (IL-1): Anakinra, Rilonacept.
* Thuốc ức chế thụ thể Interleukine 6 (IL-6): Tocilizumab (Actemra).
Không khuyến cáo dùng phối hợp các DMARDs sinh học với nhau. Thường dùng phối hợp DMARDs sinh học với với MTX. Hiện nay, ở Việt Nam chỉ mới lưu hành 3 DMARDs sinh học sau:
ETANERCEPT (Enbrel): 25 mg x 2 lần/tuần pha tiêm dưới da, liên tục trong 12 tuần. Thuốc ức chế cạnh tranh với TNF.
ABATACEPT (Mabthera): truyền tĩnh mạch 1.000mg 1 lần tuần x 2 tuần. Đánh giá lại sau 6 tháng – 1 năm trước khi quyết định điều trị nhắc lại. Thuốc ức chế hoạt hóa tế bào T.
TOCILIZUMAB (Actemra): 8 mg/kg, truyền tĩnh mạch 1 lần/tháng. Actemra là thuốc kháng thụ thể IL-6. Điều trị liên tục từ 6-12 tháng tùy đáp ứng của bệnh nhân. Tocilizumab là kháng thể đơn dòng nhân hóa tái tổ hợp kháng thụ thể interleukin-6 (IL-6), ở người là thành phần của phân nhóm globulin miễn dịch (Ig) IgG1. Tocilizumab gắn chuyên biệt với cả phần thụ thể gắn kết hòa tan và thụ thể gắn kết màng của IL-6 (sIL-6R, mIL-6R), và đã cho thấy ức chế được tín hiệu điều hòa bởi sIL-6R và mIL-6R
Đặc điểm chung của nhóm thuốc sinh học:
- Đạt hiệu quả kiểm soát tốt bệnh trên nhiều phương diện, kiểm soát được bệnh, tránh tổn thương khớp, cải thiện triệu chứng, hạn chế tàn phế và nâng cao chất lượng cuộc sống cho bệnh nhân.
- Chỉ định trong các trường hợp bệnh tự miễn (viêm khớp dạng thấp, lupus ban đỏ hệ thống, viêm cột sống dính khớp, viêm khớp vảy nến, vảy nến thể mảng...) kháng với các điều trị thông thường. Đối với bệnh viêm khớp dạng thấp, thường vẫn kết hợp với Methotrexat (MTX) nếu không có chống chỉ định. Gần đây nhóm thuốc này được nhiều tác giả khuyến khích sử dụng sớm nhằm tránh hủy khớp. Có thể lựa chọn sử dụng một loại, không đáp ứng (sau ít nhất 03 tháng) có thể chuyển sang thuốc sinh học khác.
- Các thuốc nhóm này nói chung khá an toàn nếu được theo dõi, quản lý tốt. Tác dụng không mong muốn đáng ngại nhất của các thuốc này là gây suy giảm miễn dịch làm bùng phát lao và các nhiễm khuẩn cơ hội, nhiễm virus (đặc biệt virus viêm gan B, C), ung thư. Do vậy, trước khi chỉ định thuốc sinh học, cần lưu ý khảo sát phát hiện kịp thời các các nhiễm trùng, tình trạng tiêm chủng (Không nên dùng vắc xin sống và bất hoạt đồng thời với các thuốc sinh học), phản ứng quá mẫn, bệnh gan tiến triển và suy gan. Điều trị với thuốc sinh học thường kết hợp với hợp với Methotrexat, có thể gây tăng enzym transaminases. Do đó cần thận trọng khi cân nhắc điều trị cho bệnh nhân có bệnh gan tiến triển hoặc suy gan.
2.1. Các thuốc ức chế TNF- alpha (ức chế yếu tố hoại tử khối u- alpha)
Yếu tố hoại tử khối u (TNF) là một protein do cơ thể sản sinh ra trong phản ứng với tình trạng viêm, chấn thương. TNF- α thúc đẩy hiện tượng viêm như sưng, nóng, đỏ, đau và phản ứng toàn thân như sốt. Chất này đặc biệt có vai trò quan trong trong cơ chế bệnh sinh của một số bệnh như viêm khớp dạng thấp, viêm cột sống dính khớp, thấp khớp vẩy nến, bệnh Crohn...Việc điều trị dựa trên cơ sở ức chế chất này. Ức chế TNF- alpha có thể đạt được với một protein thụ thể lưu hành hợp nhất như etanercept (Enbrel) hoặc một kháng thể đơn dòng như infliximab (Remicade), adalimumab (Humira), certolizumab pegol (Cimzia), và golimumab (Simponi). Thuộc nhóm này, etanercept (Enbrel) hiện đã được ứng dụng vào điều trị tại Việt Nam. Thuốc sử dụng đơn giản, an toàn (bệnh nhân có thể tự tiêm dưới da), ít xảy ra hiện tượng kháng thuốc nhất trong số các thuốc thuộc nhóm kháng TNF-alpha do không phải là kháng thể. Kết quả bước đầu thu được trên các bệnh nhân viêm khớp dạng thấp và viêm cột sống dính khớp Việt nam rất khả quan.
2.1.1. Etanercept-Enbrel®
Được chấp thuận vào năm 1988.
Cơ chế tác dụng: Etanercept là một protein tổng hợp có trọng lượng phân tử 150 kDa, liên kết với thụ thể TNF-α và làm giảm vai trò của TNF-α trong các biểu hiện gây nên bởi hiện tượng viêm, bao gồm các bệnh tự miễn như viêm cột sống dính khớp, viêm khớp dạng thấp, viêm khớp thiếu niên tự phát, bệnh vẩy nến, viêm khớp vảy nến...và các rối loạn khác gây ra bởi TNF-alpha. Tiềm năng điều trị này được dựa trên thực tế là TNF-alpha là "tổng thể điều chỉnh" ("master regulator") của các phản ứng viêm trong nhiều hệ thống cơ quan. Tình trạng viêm khớp thuyên giảm rõ rệt ngay sau các mũi tiêm Etanercept-Enbrel® đầu tiên.
2.1.2. Infliximab- Remicade®
Được chấp thuận vào năm 1999.
Cơ chế tác dụng: Infliximab là một kháng thể đơn dòng chống lại yếu tố hoại tử khối u alpha (TNF-alpha), đó là một kháng thể nhân tạo, tạo bởi sự kết hợp kháng thể của chuột và kháng thể của người, nên được gọi là kháng thể đơn dòng khảm. Infliximab hoạt động thông qua sự ngăn chặn TNF-alpha gắn kết với thụ thể của nó trong tế bào.
2.1.3. Adalizumab (Humira)
Được chấp thuận vào năm 2002 để ưu tiên số 2 cho điều trị viêm khớp dạng thấp, lại được chấp thuận vào năm 2005 ưu tiên số 1 cho điều trị viêm khớp dạng thấp và viêm khớp vảy nến.
Là thuốc kháng TNF được sử dụng đơn độc hoặc kết hợp với MTX hoặc các thuốc DMARDs kinh điển khác.
2.2. Thuốc ức chế tế bào B (B-cell depletion): Rituximab (MabThera®, Rituxan®)
Được chấp thuận vào năm 2006.
Cơ chế tác dụng: Rituximab là một kháng thể đơn dòng khảm, hoạt động chống lại protein CD20 chủ yếu được tìm thấy trên bề mặt của các tế bào B. Rituximab được sử dụng trong điều trị u lympho, bệnh bạch cầu, thải ghép và một số rối loạn tự miễn dịch.
2.3. Thuốc ức chế tế bào T
Được chấp thuận vào năm 2005.
ABATACEPT (Mabthera). Thuốc ức chế hoạt hóa tế bào T, còn được gọi là tác nhân điều biến đồng kích thích tế bào B (T cell co-stimulation modulator). Thuốc ngăn cản sự hoạt hóa tế bào T: truyền tĩnh mạch 1.000mg 1 lần tuần x 2 tuần. Đánh giá lại sau 6 tháng – 1 năm trước khi quyết định điều trị nhắc lại.
2.4. Thuốc ức chế interleukin-1 (anti-IL-1): Anakinra (Kineret)
Được chấp thuận vào năm 2001.
Anakinra là một kháng thể đơn dòng kháng lại thụ thể của IL-1. Thuốc có tác dụng ức chế IL-1.
2.5. Thuốc ức chế các Interleukin-6 (IL-6): tocilizumab (Actemra ®)
Cơ chế tác dụng: tocilizumab (Actemra®) là kháng thể đơn dòng kháng thụ thể interleukin-6 (IL-6) ở người được nhân hoá tái tổ hợp, là thành phần của phân nhóm globulin miễn dịch (Ig) IgG1. Trên cơ sở hiểu biết IL-6 là một cytokine đa chức năng có tác động sinh học rộng lớn điều hòa nhiều quá trình bao gồm các đáp ứng viêm cấp tại gan, chuyển hóa sắt, tạo máu, chuyển hóa xương và các bệnh lý tim mạch. IL-6 ảnh hưởng đến khớp thông qua sản xuất yếu tố tăng trưởng nội mạc mạch máu (vascular endothelial growth factor -VEGF) góp phần hình thành màng máu màng hoạt dịch Panus, kích thích hủy cốt bào trưởng thành và tăng hoạt hóa, và là chất trung gian trong quá trình viêm mạn tính (tập hợp bạch cầu). IL-6 gây các triệu chứng toàn thân do IL-6 là tác nhân kích thích chính trong tổng hợp protein viêm giai đoạn cấp (CRP); có mối liên quan giữa IL-6 và tình trạng thiếu máu trong bệnh lý viêm; IL-6 kích thích tổng hợp cả acid béo của gan và ly giải mô mỡ gây rối loạn lypid máu và tăng nguy cơ các biến cố tim mạch. IL-6 tác động trên hệ miễn dịch do đóng vai trò chính trong điều hòa các tác nhân tham gia vào quá trình miễn dịch dịch thể (tế bào B), miễn dịch tế bào (tế bào T), hủy cốt bào. IL-6 có thể duy trì đáp ứng tự kháng thể trong viêm khớp dạng thấp thông qua hoạt hóa TH17. Chính vì vậy tocilizumab ức chế IL-6 sẽ đạt các hiệu quả như một điều trị thông qua cơ chế bệnh sinh. Các ứng dụng thuốc trên bệnh nhân Việt Nam bước đầu đã có hiệu quả tốt.
Khi sao lưu xin trích dẫn nguồn, tác giả xin cảm ơn.