Hiện tượng Hayflick và giới hạn tuổi thọ của con người (125 tuổi)
PGS.TS. Hà Hoàng Kiệm, BVQY103, HVQY
Hiện tượng Hayflick hay giới hạn Hayflick
Leonard Hayflick sinh ra tại Philadelphia, Pennsylvania ngày 20 tháng 5 năm 1928, ông là nhà nghiên cứu y sinh học làm việc tại Viện Wistar (Hoa Kỳ). Năm 1958, Hayflick bắt đầu nghiên cứu xem liệu virus có thể gây ung thư ở người hay không. Ông sử dụng các các virus được cho là gây ung thư và đưa chúng vào các tế bào khỏe mạnh của người để tìm kiếm căn cứ khẳng định. Để làm cho nghiên cứu không bị sai lệch, ông phải sử dụng nhiều mẫu, để làm điều này ông phải nuôi cấy tế bào. Theo dõi quá trình nuôi cấy tế bào, Hayflick phát hiện một số nhóm tế bào già hơn ngừng phân chia. Điều này là không bình thường vì ở thời điểm đó theo Alexis Carrel người đoạt giải Nobel đã tuyên bố rằng "tất cả các tế bào được nuôi cấy trong nuôi cấy mô là bất tử, và việc thiếu sự sao chép tế bào liên tục là do sự thiếu hiểu biết về cách nuôi cấy tế bào tốt nhất” mặc dù các nhà khoa học khác đã không lặp lại được thí nghiệm của Carrel. Từ hiện tượng trên, Hayflick nghi ngờ những tuyên bố của Carrel. Hayflick nhận thấy rằng một trong những môi trường nuôi cấy nguyên bào sợi người của ông, sự phân chia tế bào đã chậm lại và ngừng phân chia. Ban đầu, ông gạt phát hiện này sang một bên và coi nó là một sự bất thường do nhiễm bẩn hoặc lỗi kỹ thuật. Tuy nhiên, sau đó ông đã quan sát các môi trường nuôi cấy tế bào khác cũng có biểu hiện tương tự. Hayflick kiểm tra các nghiên cứu của mình và rất ngạc nhiên khi thấy rằng các tế bào được nuôi cấy trong môi trường nuôi cấy tế bào chỉ đạt đến xấp xỉ lần nhân đôi thứ 40 trong khi các điều kiện như môi trường nuôi cấy, vật chứa môi trường hay kỹ thuật viên đều là tương tự nhau giữa các môi trường nuôi cấy mà ông quan sát. Điều này đã loại trừ nghi ngờ việc các kết quả trên xảy ra là do nhiễm bẩn hoặc lỗi kỹ thuật.
Hayflick đặt ra mục tiêu chứng minh rằng việc chấm dứt khả năng sao chép tế bào bình thường mà ông quan sát được không phải là do sự lây nhiễm virus, điều kiện nuôi cấy kém hay một số yếu tố không xác định. Hayflick đã chứng minh được rằng việc ngừng nhân đôi của tế bào bình thường đã được điều chỉnh bởi một cơ chế đếm bên trong. Những kết quả này đã bác bỏ tuyên bố của Carrel và xây dựng nên giới hạn Hayflick. Không giống như thí nghiệm của Carrel, Thí nghiệm của Hayflick đã được các nhà khoa học khác tái hiện thành công.
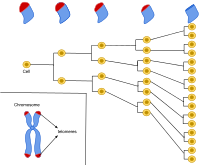
Hình 1. Tế bào thai nhi bình thường điển hình của con người sẽ phân chia từ 40 đến 60 lần trước khi bị lão hóa. Khi tế bào phân chia, các telomere ở hai đầu của nhiễm sắc thể sẽ rút ngắn. Giới hạn Hayflick là giới hạn sao chép tế bào đạt được trong quá trình rút ngắn telomere với mỗi phần. Giai đoạn cuối này được gọi là lão hóa tế bào.
Giới hạn Hayflick được hiểu là một quần thể tế bào của bào thai người bình thường sẽ có giới hạn phân chia từ 40 đến 60 lần trong nuôi cấy tế bào. Các tế bào không chết khi chúng tiếp tục trao đổi chất, nhưng chúng sẽ không phân chia nữa và bị lão hóa rồi chết theo chương trình. Như vậy trong môi trường tối ưu, số lần phân chia của các tế bào là có giới hạn, giới hạn này được xác định bởi các telomere của nhiễm sắc thể.
Mỗi khi một tế bào trải qua quá trình nguyên phân, các teromere ở hai đầu của mỗi nhiễm sắc thể sẽ rút ngắn lại một chút. Sự phân chia tế bào sẽ chấm dứt khi telomere rút ngắn đến một chiều dài tới hạn. Các telome giống như đồng hồ đếm ngược số lần phân chia tế bào. Hayflick giải thích khám phá của mình là sự lão hóa ở cấp độ tế bào. Sự lão hóa của quần thể tế bào dường như tương quan với sự lão hóa vật lý tổng thể của một sinh vật.
Teromere là gì?
Telomere là đoạn cuối của ADN trong nhiễm sắc thể, là “đầu bịt” bảo vệ các nhiễm sắc thể. Mỗi lần phân bào, đoạn telomere bị ngắn đi một ít.
Từ những năm 1930, hai nhà khoa học Hermann Muller (giải Nobel năm 1946) và Barbara McClintock (giải Nobel năm 1983) đã phát hiện thấy ở động vật có vú, các đầu tận cùng của nhiễm sắc thể được bảo vệ bằng các telomere (theo tiếng Hy Lạp, telo có nghĩa là cuối, còn mere là phần, telomere là phần cuối), tức là những cấu trúc đặc biệt được hình thành bởi các chuỗi TTAGGG lặp lại kế tiếp nhau.
Mặc dù cũng được cấu thành từ các đơn phân nucleotide, nhưng telomere không mã hóa protein và mỗi telomere gồm nhiều đoạn nucleotide lặp lại. Chẳng hạn, ở động vật có xương sống trình tự lặp lại này là TTAGGG.
Khi sao chép nhiễm sắc thể, hệ enzym nhân đôi ADN mà chủ yếu là ADN polymerase không thể nhân đôi toàn bộ chiều dài của phân tử này từ đầu đến cuối của một nhiễm sắc thể, bởi vì sự tổng hợp gián đoạn ở mạch cuộn của telomere (mạch cuộn cần sự gắn kết các đoạn Okazaki đòi hỏi mồi gắn), nên mỗi lần nhân đôi thì DNA trong nhiễm sắc thể bị rút ngắn đi một chút.
Ở tuổi thanh niên, mỗi telomere có kích thước khoảng từ 8.000 đến 10.000 phân tử. Nhưng vì lý do trên, mà sau nhiều lần nhân đôi thì "đầu mút" này ngắn đi đáng kể và cuối cùng có thể mất khả năng bảo vệ DNA khỏi quá trình phân giải và đột biến, khiến con người lão hoá nhanh hơn và phát sinh một số bệnh tật.
Ở người các chuỗi lặp lại của telomere có từ 5.000 đến 15.000 base và chúng lặp đi lặp lại khoảng 2.500 lần. Telomere có nhiệm vụ bảo đảm sự bền vững của các chromosome, chống lại thoái hóa tế bào, chống lại sự tái tổ hợp sai lạc và có vai trò điều hòa gen.Nhưng chiều dài telomere trung bình giảm từ khoảng 11 kilobases khi sinh ra còn dưới bốn kilobases khi đến tuổi già, với tỷ lệ suy giảm trung bình của nam lớn nhiều hơn ở phụ nữ (có thể điều đó giải thích vì sao đa số nam giới thường chết sớm hơn nữ giới!).
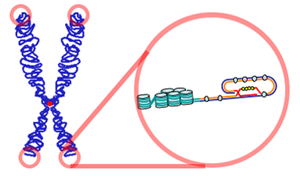
Hình 2. Cấu trúc của telomere có mạch cuộn ở đoạn cuối..
Các tế bào sống của người bình thường không nhất thiết phải phân chia thường xuyên khiến các nhiễm sắc thể vẫn duy trì một chiều dài các telomere một cách tương đối, nhưng nói chung đều có một đời sống có giới hạn. Thông thường tế bào chết đi sau 40-60 chu kỳ phân chia. Trong quá trình phân chia, một phần cuối của các telomere (chuỗi AND) lại không có khả năng sao chép được và vì thế sau mỗi lần phân chia, các nhiễm sắc thể đều bị ngắn đi một chút do mất một số lượng nào đó của telomere (khoảng chừng 50-100 base), vì thế có nhà khoa học ví quá trình này giống như sự xổ ra ở đầu sợi dây giầy làm bằng bấc. Khi các telomere trở nên quá ngắn thì các nhiễm sắc thể sẽ kém bền vững, chúng không thể bám vào được màng nhân tế bào, bị dính vào nhau và có hình dạng kỳ dị. Hậu quả là các tế bào không thể phân chia được nữa vì thế các mô không được đổi mới. Các nhà khoa học nhận thấy nếu các telomere liên tục ngắn lại thì tế bào sẽ lão hóa nhanh.
Enzym telomerase
Greider và Blackburn đã phát hiện ra telomerase - một enzym (bao gồm cả RNA lẫn protein) có vai trò giúp các phân tử ADN sao chép toàn bộ nhiễm sắc thể mà không bị mất đi đoạn cuối cùng. Và họ khẳng định rằng telomerase sẽ chỉnh sửa lại quá trình phân chia tế bào, giúp tái sinh phần đầu của nhiễm sắc thể.
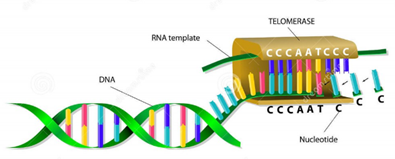
Hình 3. Cơ chế hoạt động của telomerase
Thành phần ARN của telomerase người có chừng 445 nucleotid, trong đó các nucleotid 46-56 là vị trí gắn vào đầu cùng của telomere, và đó là khuôn để từ đó thêm vào các ADN của telomere. Cơ chế bảo vệ telomere là enzym telomerase sẽ nhận dạng đầu cùng của telomere thông qua các hoạt động giữa telomere và cả 2 tiểu đơn vị hTR và hTERT của telomerase, nhận dạng xong thì thêm chuỗi sáu base TTAGGG của telomere, như vậy là kéo dài thêm một telomere và cứ thế tiếp tục.
Sự lão hóa và giới hạn tuổi thọ của con người tối đa là 125 tuổi
Các nghiên cứu của các nhà khoa học giúp giải thích bản chất của tình trạng lão hóa. Telomere rút ngắn đi ở người gây nên sự lão hóa, cơ chế này xuất hiện để ngăn chặn sự bất ổn định và phát triển của bệnh ung thư, ngăn các tế bào già nhân gen của chúng bằng cách hạn chế số lượng các tế bào phân chia. Tuy nhiên, các telomere ngắn lại làm giảm chức năng miễn dịch cũng có thể làm tăng tính nhạy cảm của bệnh ung thư. Khi các telomere trở nên quá ngắn, các tế bào hoặc ngừng phát triển dẫn đến tuổi già của tế bào (lão hóa ), hoặc bắt đầu chết theo chương trình (apoptosis – giải Nobel 2016) tùy thuộc vào nền tảng di truyền của tế bào, khi tổn thương này không thể được sửa chữa trong các tế bào bình thường, các tế bào có thể đi vào quá trình apoptosis. Nhiều bệnh lão hóa liên quan đến các telomere ngắn lại. Các mô của các cơ quan xấu đi khi ngày càng nhiều các tế bào của chúng chết đi hoặc lão hóa.
Telomere rất quan trọng cho việc duy trì tính toàn vẹn di truyền, nhiều Nghiên cứu quan sát thấy telomere ngắn lại trong nhiều bệnh ung thư: bao gồm cả tuyến tụy, xương, tuyến tiền liệt, bàng quang, phổi, thận, đầu và cổ. Ngoài ra, những người có nhiều loại ung thư đã được tìm thấy có telomere bạch cầu ngắn hơn so với người khỏe mạnh. Một số các yếu tố trong lối sống làm tăng nguy cơ phát triển ung thư cũng đã được phát hiện có kết hợp với các telomere ngắn lại: bao gồm stress, hút thuốc lá, ít vận động và chế độ ăn nhiều đường tinh chế. Chế độ ăn uống, hoạt động thể chất, viêm và stress oxy hóa được cho là ảnh hưởng đến bảo trì telomere.
Hiện tượng Hayflick cho thấy tế bào trong môi trường tối ưu chỉ có thể phân chia tối đa đến 60 lần rồi lão hóa và chết theo chương trình, từ giới gạn này các nhà khoa học tính toán được rằng tuổi thọ tối đa của con người có thể đạt được là 125 tuổi. Nhưng trong đời sống con người không thể đảm bảo môi trường tối ưu cho mọi tế bào, các gốc tự do sinh ra trong quá trình chuyển hóa của tế bào, các chất độc từ nội môi và ngoại môi, các chất phóng xạ và hóa chất mà con người phơi nhiễm trong quá trình sống… đều là các yếu tố làm rút ngắn các telomere, làm giảm số lần phân chia của tế bào, làm tế bào không thể đạt được số lần phân chia tối đa. Vì cơ thể chúng ta chỉ được tạo thành từ các tế bào, các tế bào trong mô các cơ quan trong cơ thể tuân theo giới hạn Hayflick, chúng có giới hạn số lần phân chia và bị lão hóa rồi chết theo chương trình. Sự lão hóa các cơ quan trong cơ thể, như trong bệnh thoái hóa khớp, được lý giải bằng hiện tượng Hayflick đã được chúng tôi đề cập đến trong cuốn sách "Bệnh thoái hóa khớp, chẩn đoán, điều trị và dự phòng" (Hà Hoàng Kiệm, NXB TT và DL 2018, trang 24), điều này cũng giải thích tại sao cái chết do tuổi già là một điều hiển nhiên.
Tài liệu tham khảo
2. https://suckhoedoisong.vn/telomere-telomerase-va-giai-nobel-y-hoc-1699119.htm
3. https://vi.wikipedia.org/wiki/Telomere