Các công nghệ sản xuất vaccine và quy trình thử nghiệm
Hà Hoàng Kiệm, BVQY 103, HVQY
1. Tỉ lệ thành công của các vaccine
Trong số tất cả các loại vaccine được nghiên cứu trong phòng thí nghiệm và động vật thí nghiệm, chỉ có khoảng 7% ứng các vaccine là đủ tốt để chuyển sang thử nghiệm lâm sàng (thử nghiệm trên người). Trong số các loại vaccine được đưa vào thử nghiệm lâm sàng, chỉ có khoảng 20% là thành công.
2. Các loại vaccine
Có 3 cách tiếp cận chính để thiết kế ra các loại vaccine. Sự khác biệt chính của 3 cách thiết kế đó là:
- Sử dụng toàn bộ virus hay vi khuẩn để tạo ra vaccine.
- Chỉ sử dụng những thành phần của virus có tác dụng khởi phát hệ thống miễn dịch (thành phần có tính kháng nguyên).
- Chỉ sử dụng những vật liệu di truyền (AND, ARN) của virus nhằm cung cấp cho cơ thể các hướng dẫn để tổng hợp ra các protein cụ thể (giống protein là kháng nguyên có trong virus) có tác dụng khởi phát hệ thống miễn dịch.
.jpg)
2.1. Vaccine sử dụng toàn bộ virus hay vi khuẩn
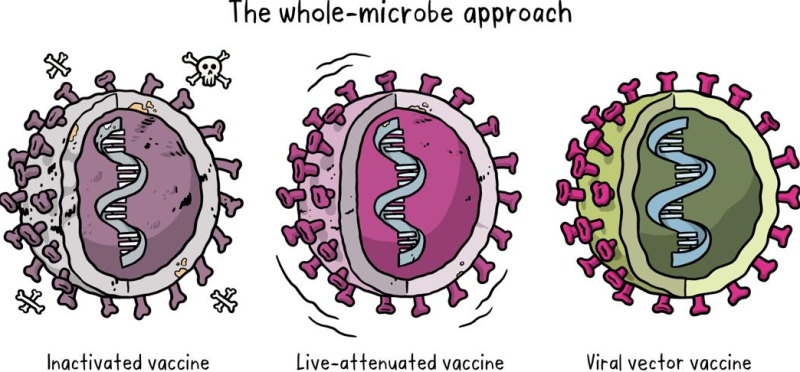
- Vaccine bất hoạt (Inactivated vaccine) còn gọi là vaccine chết
Cách đầu tiên để tạo ra vaccine là lấy chính các virus hoặc vi khuẩn gây bệnh làm bất hoạt (làm chết) chúng bằng cách sử dụng hóa chất, nhiệt hoặc bức xạ. Cách tiếp cận công nghệ này đã được chứng minh là có hiệu quả và đây là cách sản xuất ra các vaccine cúm và bại liệt, với loại vaccine này có thể được sản xuất ở quy mô hợp lý. Tuy nhiên, đòi hỏi các cơ sở phải có những phòng thí nghiệm đặc biệt để nuôi cấy virus hoặc vi khuẩn một cách an toàn, đòi hỏi thời gian sản xuất tương đối dài và có thể sẽ cần tiêm nhắc lại 2 hoặc 3 liều.
- Vaccine sống giảm độc lực (Live-attenuated vaccine)
Cách thứ hai của nhóm này là lấy chính các virus hoặc vi khuẩn gây bệnh còn sống làm cho chúng suy yếu đi không còn đủ khả năng gây bệnh. Vaccine sởi, quai bị, rubella (MMR) và thủy đậu là những ví dụ điển hình về loại vaccine này. Cách tiếp cận công nghệ tương tự như vaccine bất hoạt và có thể được sản xuất ở quy mô lớn. Tuy nhiên, những loại vaccine như thế này không phù hợp với những người có hệ miễn dịch yếu vì chúng có thể gây bệnh cho những người này.
- Vaccine vectơ virus (Viral vector vaccine) hay vaccine sử dụng virus an toàn
Cách thứ ba là sử dụng một loại virus khác không gây bệnh (virus an toàn), cấy vào nó một vài bộ phận cụ thể (là protein có tính kháng nguyên) của virus gây bệnh để cung cấp các thành phần cụ thể của virus gây bệnh để nó kích hoạt phản ứng miễn dịch của cơ thể mà không gây bệnh. Để làm điều này, đòi hỏi phải đưa một vài bộ phận cụ thể (là protein có tính kháng nguyên) của virus gây bệnh vào bên trong một virus an toàn. Sau đó, virus an toàn đóng vai trò như một véc tơ để đưa protein của virus gây bệnh vào cơ thể. Protein này sẽ kích hoạt phản ứng miễn dịch. Vaccine Ebola là điển hình của loại vaccine vectơ virus và cách này là một trong những công nghệ đang được nghiên cứu và phát triển vaccine cho COVID-19. Vaccine ngừa COVID-19 của Johnson & Johnson's Janssen là vaccine được sản xuất theo công nghệ vector virus này.
2.2. Vaccine sử dụng một phần của virus (vaccine tiểu đơn vị)
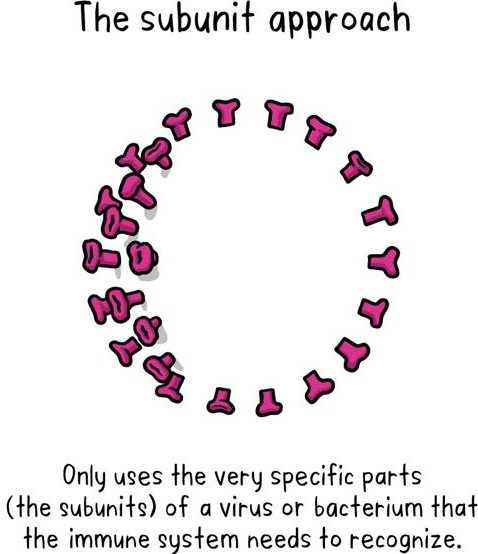
Là những vaccine chỉ sử dụng những phần rất cụ thể (các tiểu đơn vị) có tính kháng nguyên của virus hoặc vi khuẩn mà hệ thống miễn dịch có thể nhận biết. Loại vaccine này không chứa toàn bộ virus cũng không sử dụng virus an toàn làm trung gian chuyên chở (vectơ). Các tiểu đơn vị có thể là protein hoặc đường. Hầu hết các loại vaccine trong lịch tiêm chủng cho trẻ em là vắc xin tiểu đơn vị, bảo vệ người dân khỏi các bệnh như ho gà, uốn ván, bạch hầu và viêm màng não mô cầu.
2.3. Vaccine sử dụng acid nucleic của virus
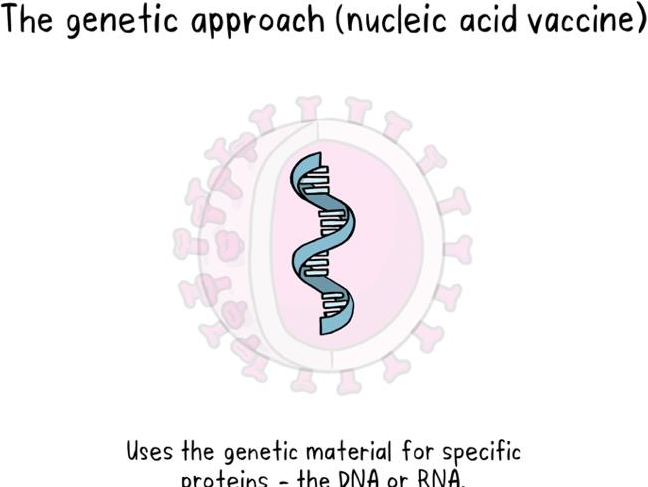
Không giống như các phương pháp tiếp cận vaccine sử dụng toàn bộ vi khuẩn bị làm suy yếu hoặc chết hoặc các bộ phận của một vi khuẩn, vaccine acid nucleic chỉ sử dụng một phần vật liệu di truyền (DNA hoặc RNA) để cung cấp hướng dẫn cho cơ thể tổng hợp ra các protein cụ thể có tính kháng nguyên của vi khuẩn hoặc virus, không phải toàn bộ vi khuẩn hay virus. DNA đầu tiên được cơ thể sử dụng để tạo ra RNA thông tin (messenger RNA), từ đó làm bản thiết kế để tổng hợp ra các protein cụ thể.
Vaccine acid nucleic cung cấp một tập hợp các hướng dẫn cụ thể cho các tế bào của cơ thể con người, dưới dạng DNA hoặc mRNA, để chúng tổng hợp ra các protein cụ thể có tính kháng nguyên (tương tự protein của vi rút gây bệnh) giúp hệ thống miễn dịch của cơ thể nhận ra và đáp ứng.
Phương pháp tiếp cận acid nucleic là một cách mới nhất để phát triển vaccine. Trước đại dịch COVID-19, chưa có loại vaccine nào vượt qua quy trình phê duyệt để sử dụng cho người, mặc dù đã có một số vaccine DNA, bao gồm cả các vaccine ngừa bệnh ung thư đang được thử nghiệm trên người. Do đại dịch, nghiên cứu trong lĩnh vực này đã tiến triển rất nhanh và một số vaccine mRNA cho COVID-19 đã và đang được cấp phép sử dụng.
2.4. Vaccine tái tổ hợp protein
Vaccine tái tổ hợp protein là vaccine chứa các protein kháng nguyên được tái tổng hợp bằng công nghệ gen.
Các protein vỏ vi khuẩn hoặc gai của virus là các kháng nguyên, cái mà làm cho hệ miễn dịch cơ thể nhận biết vi khuẩn hoặc virus. Người ta lấy đoạn gen mã hóa cho quá trình tổng hợp protein kháng nguyên của vi khuẩn hoặc virus, cấy vào tế bào vật chủ để chúng tổng hợp ra protein kháng nguyên và tách chiết protein đó, tinh khiết chúng để làm vaccine. Như vậy các vaccine này chỉ chứa các protein là kháng nguyên của vi khuẩn hoặc virus chứ không phải vi khuẩn hoặc virus.
Novavax: là vaccine sản xuất theo công nghệ tái tổ hợp protein hạt nano do công ty Novavax của Mỹ sản xuất; Nanocovax: là vaccine sản xuất theo công nghệ tái tổ hợp protein do công ty Nanogen Việt Nam sản xuất đang trong giai đoạn thử nghiệm lâm sàng giai đoạn 3.
3. Các giai đoạn thử nghiệm vaccine
Vaccine được coi là một loại “thuốc” vì nó hội đủ các đặc điểm của một loại thuốc (medicine) theo tiêu chuẩn dược điển. Tuy nhiên, vaccine được xem là một loại thuốc đặc biệt. Trước hết vì nó được dùng chủ yếu cho những người đang mạnh khỏe, trong đó số đông là trẻ em, có cả trẻ sơ sinh. Sau nữa nó được sử dụng theo những liều, lịch tiêm có kế hoạch định trước. Cuối cùng nó được liệt vào danh mục những chế phẩm thuốc có độ an toàn cao nhất trong điều kiện sử dụng đúng chỉ định và tuân thủ đúng quy trình tiêm chủng. Tuy nhiên vì là một “thuốc” tức là một “chất lạ” đối với cơ thể người nhận, nó có thể gây ra những tác dụng phụ, còn gọi là biến cố bất lợi (adverse events), thậm chí là bất lợi nghiêm trọng (serious adverse events) sau tiêm chủng. Các ngành Y – Dược học có nhiệm vụ hạn chế tối đa những biến cố bất lợi này, cũng chính là góp phần bảo đảm cao nhất tính an toàn cho vaccine và cho tiêm chủng dự phòng.
Thử nghiệm lâm sàng thuốc là hoạt động khoa học nghiên cứu thuốc trên người nhằm xác minh hiệu quả lâm sàng; nhận biết, phát hiện phản ứng bất lợi do tác động của sản phẩm thuốc; khả năng hấp thu, phân bố, chuyển hóa, thải trừ của sản phẩm đó; xác định sự an toàn và hiệu quả của thuốc nghiên cứu. Thử nghiệm lâm sàng vaccine tuân thủ đúng theo định nghĩa về Thử nghiệm lâm sàng thuốc. “Thuốc’ ở đây chính là chế phẩm vaccine mới, hoặc là một vaccine đang được sử dụng nhưng nay có thay đổi nhất định trong công thức, quy trình, địa điểm sản xuất hay có nhu cầu mở rộng diện đối tượng và/hoặc phạm vi địa lý dân cư khi sử dụng. Thử nghiệm lâm sàng vaccine thường đòi hỏi số đối tượng thử nghiệm nhiều khi lớn hơn (có khi tới hàng chục nghìn người) so với số đối tượng của nhiều loại thuốc chữa bệnh khác.
Để có một chế phẩm vaccine mới đưa vào đời sống phải trải qua những bước nghiên cứu, sản xuất ở phòng thí nghiệm, sản xuất công nghiệp, kiểm tra, thẩm định, đánh giá chất lượng rất nghiêm ngặt, thường mất từ 5 tới 10 năm, trong đó khoảng một nửa thời gian dành cho các bước thử nghiệm lâm sàng. Vaccine trước hết phải được sản xuất trên dây chuyền đạt tiêu chuẩn về thực hành sản xuất thuốc tốt (GMP) và phải đảm bảo tính ổn định trong 3 lô liên tiếp. Trước khi được đưa vào thử nghiệm lâm sàng vaccine phải được chứng minh là an toàn và hiệu quả trong các nghiên cứu tiền lâm sàng, gồm đánh giá trong phòng thí nghiệm (invitro) và nghiên cứu trên động vật thực nghiệm (invivo), đồng thời phải có xác nhận an toàn của cơ quan kiểm định thuốc quốc gia.
BS Katherine O’Brien chuyên gia của WHO (trong chương trình Science in 5) cho biết thử nghiệm vaccine bao gồm các giai đoạn:
3.1. Giai đoạn sản xuất vaccine trong phòng thí nghiệm
Vaccine đã được sản xuất thành thành phẩm đạt tiêu chuẩn quy định và phải đảm bảo tính ổn định trong 3 lô liên tiếp. Trước khi được đưa vào thử nghiệm lâm sàng vaccine phải được chứng minh là an toàn và hiệu quả trong các nghiên cứu tiền lâm sàng, gồm đánh giá trong phòng thí nghiệm (invitro) sẵn sàng cho thử nghiệm.
3.2. Giai đoạn thử nghiệm trên động vật
Vaccine được thử nghiệm trên một số động vật để xác định liều độc (LD50 - tức là liều mà vaccine làm chết 50% động vật thí nghiệm). Bước đầu xác định Vaccine có tác dụng sinh kháng thể hay không và liều tác dụng sinh kháng thể.
3.3. Thử nghiệm lâm sàng
Thử nghiệm lâm sàng được tiến hành qua 3 giai đoạn, hoàn thành giai đoạn trước được đánh giá là đạt tiêu chuẩn mới được tiến hành tiếp giai đoạn sau. Trong một giai đoạn nếu xuất hiện các tác dụng không mong muốn nguy hiểm phải dừng thử nghiệm để đánh giá lại xem có được tiếp tục thực hiện hay phải ngừng hẳn. Nếu chưa hết giai đoạn thử nghiệm nhưng cho kết quả vượt trội ngoài mong đợi có thể đánh giá để rút ngắn thời gian thử nghiệm.
3.3.1. Thử nghiệm lâm sàng giai đoạn 1
Thử nghiệm lâm sàng giai đoạn 1 là thử nghiệm quy mô nhỏ và là lần đầu tiên một loại vaccine mới được đánh giá hiệu quả trên người. Đó là những vaccine đã hoàn thành giai đoạn sản xuất trong phòng thí nghiệm, đã được thử nghiệm trên một số động vật. Bắt đầu từ liều thấp đến liều được đề xuất dựa trên liều được ngoại suy từ kết quả dò liều an toàn và hiệu quả trên động vật thực nghiệm, với mục tiêu chính là đánh giá tính an toàn của vaccine.
Toàn bộ những thử nghiệm giai đoạn 1 được tiến hành ở nhóm người trẻ và khỏe mạnh. Số lượng người tham gia thử nghiệm thông thường 30 - 50 đối tượng hoặc có thể lên tới 100 người.
Mục tiêu của giai đoạn 1 là:
- Mục tiêu thứ nhất là: Đánh giá liều lượng vaccine thử nghiệm và tìm ra liều lượng chuẩn.
- Mục tiêu thứ hai là: Đánh giá xem vaccine có tạo ra phản ứng miễn dịch mà chúng ta mong muốn hay không.
- Mục tiêu thứ ba là: Để tập hợp dần các dữ liệu về sự an toàn của vaccine.
Nếu thử nghiệm vaccine vượt qua được giai đoạn 1, tức là chỉ ra được một số đáp ứng miễn dịch thì có thể được tiến hành giai đoạn 2.
3.3.2. Thử nghiệm lâm sàng giai đoạn 2
Thử nghiệm lâm sàng giai đoạn 2 là bước tiếp theo sau thử nghiệm lâm sàng giai đoạn 1. Số lượng người tham gia thử nghiệm ở giai đoạn 2 nhiều hơn so với giai đoạn 1, cỡ mẫu tối thiểu 200. Thử nghiệm ở giai đoạn 2 bắt đầu tập trung vào nhóm tuổi đích mà vaccine hướng tới.
Mục tiêu của thử nghiệm lâm sàng giai đoạn 2 là:
- Mục tiêu thứ nhất: Kiểm tra đáp ứng miễn dịch trên số lượng người nhiều hơn, cỡ mẫu tối thiểu 200.
- Mục tiêu thứ hai: Kiểm tra chi tiết hơn về đáp ứng miễn dịch do vaccine tạo ra đồng thời lựa chọn liều, lịch dùng thích hợp.
- Mục tiêu thứ ba: Thu thập dữ liệu lớn hơn về sự an toàn của vaccine.
Nếu các thử nghiệm vaccine vượt qua được giai đoạn 2, tức đạt được đáp ứng miễn dịch như mong đợi trên nhóm tuổi đích và có dữ liệu về độ an toàn tốt thì sẽ bước sang thử nghiệm lâm sàng giai đoạn 3.
3.3.3. Thử nghiệm lâm sàng giai đoạn 3
Trong giai đoạn 3, vaccine được thử nghiệm trên số lượng người lớn hơn rất nhiều, cỡ mẫu tối thiểu 500 đối tượng và thử nghiệm trên diện rộng, tại nhiều địa điểm (đa trung tâm), sử dụng phác đồ tiêm chủng được lựa chọn từ giai đoạn 2.
Mục tiêu của thử nghiệm lâm sàng giai đoạn 3 là:
- Mục tiêu thứ nhất: Cũng là mục tiêu quan trọng nhất của giai đoạn này là tiếp tục tích lũy bằng chứng về sự an toàn của vaccine. Đánh giá tính an toàn và hiệu quả của vắc xin trên một nhóm cộng đồng lớn hơn, gần với đối tượng đích (sẽ sử dụng vắc xin), bao gồm cả trẻ em và người cao tuổi.
- Mục tiêu thứ hai: Để biết vaccine có thật sự bảo vệ con người khỏi căn bệnh mà vaccine này đang nhắm tới hay không.
Thử nghiệm lâm sàng giai đoạn 3 cũng như thử nghiệm trong giai đoạn 2 được thiết kế, trong đó một nhóm người được tiêm vaccine và một nhóm người khác được tiêm một sản phẩm khác không phải là vaccine đang được nghiên cứu, đôi khi còn được gọi là giả dược. Sau đó so sánh tỉ lệ mắc bệnh trên những người được tiêm vaccine và trên những người không được tiêm vaccine, qua đó có thể biết vaccine đó có giúp phòng ngừa bệnh được hay không.
Kết quả thử nghiệm các giai đoạn trước phải đảm bảo tính an toàn trong giới hạn cho phép mới được tiến hành sang giai đoạn tiếp theo. Trong mỗi giai đoạn thử nghiệm lâm sàng, mọi loại biến cố bất lợi xảy ra dù nặng hay nhẹ, liên quan hay chưa được chứng minh có liên quan đến sản phẩm nghiên cứu, xảy ra ở bất kỳ thời điểm, địa điểm nghiên cứu nào đều phải được ghi nhận, báo cáo kịp thời cho nhà sản xuất, hội đồng đạo đức và cơ quan quản lý để được xem xét, phân tích, quy kết nguyên nhân. Kết quả phân tích có thể được đưa ra thẩm định chéo bởi những cơ sở nghiên cứu độc lập trong nước và quốc tế.
Trong trường hợp có thông tin về một số người có biểu hiện triệu chứng hoặc có phản ứng bất lợi xảy ra thì thử nghiệm lâm sàng vaccine bị dừng lại. Trên nguyên tắc thận trọng, nếu có ai tham gia thử nghiệm lâm sàng mà có biểu hiện triệu chứng hoặc bị mắc một bệnh không lường trước hoặc có tính chất nghiêm trọng thì thử nghiệm lâm sàng sẽ phải dừng lại. Lý do dừng lại là cần phải tiến hành đánh giá để tìm hiểu xem có phải do người đó đã được nhận vaccine hay người đó đã không nhận được vaccine khi họ ở trong nhóm nhận giả dược, liệu triệu chứng hoặc căn bệnh đó có liên quan đến hoặc không liên quan đến sản phẩm họ đã nhận trong quá trình thử nghiệm lâm sàng. Sau đó Hội đồng đánh giá thử nghiệm quyết định có cho phép vaccine được tiếp tục thử nghiệm hay phải dừng vĩnh viễn.
Nếu một chế phẩm vắc xin được xác minh là nguyên nhân (ngay cả khi còn ở mức “nghi ngờ”) của các biến cố bất lợi nghiêm trọng với tần số không cho phép, thì chúng sẽ bị loại không được thử nghiệm ở giai đoạn tiếp theo hoặc không được xét cấp phép lưu hành cho cộng đồng. Với quy trình 3 giai đoạn thử nghiệm chặt chẽ có sự đánh giá nghiêm ngặt của hội đồng đạo đức các cấp, có thể nói một vắc xin trước khi tới cơ thể người sử dụng đã được sàng lọc kỹ càng và bảo đảm cao về tính an toàn. Điều này góp phần lý giải tại sao tỷ lệ gây biến cố nghiêm trọng sau tiêm chủng của hầu hết các vaccine đã và đang lưu hành hiện nay thường ở mức rất thấp, xung quanh 1 trường hợp trên 1 triệu liều dùng đại trà.
3.3.4. Thử nghiệm sau cấp phép
Những vaccine đã được cấp phép lưu hành trên thị trường (sau thử nghiệm giai đoạn 3) phải được xác nhận tính an toàn trong quá trình sử dụng (thử nghiệm sau cấp phép) với số lượng đối tượng thử nghiệm có thể lên tới hàng chục nghìn người
Tài liệu tham khảo:
1. Sở y tế thành phố Hồ Chí Minh. (Tài liệu tham khảo: “The different types of COVID-19 vaccines”, www.who.int, 2021). http://www.medinet.hochiminhcity.gov.vn/phong-chong-dich-benh/tim-hieu-cac-loai-vac-xin-covid-19-cmobile2-42740.aspx.
4. Dược điển Việt nam. NXB Y học, Hà nội 2001 (Tái bản).
5. Nguyễn Thị Kim Tiến (Chủ biên). Thử nghiệm lâm sàng vắc xin tại Việt Nam. NXB Y học, Hà Nội 2011.
6. Bộ Y tế. Hướng dẫn thử nghiệm trên lâm sàng. NXB Y học, 2010, trang 1-2.
7. National Institute of Health – US. The Jordan Report Accelerated evelopment of vaccine. NIH Publication No.06-6057, May 2007 (www.niad.nih. gov).
8. Bộ Y tế. Thông tư số 03/2012/TTBYT hướng dẫn về thử thuốc trên lâm sàng. Hà Nội, tháng 2/2012.