Actemra (Tocilizumab), thuốc sinh học mới kháng IL-6 trong điều trị viêm khớp dạng thấp
PGS.TS. Hà Hoàng Kiệm, BVQY103, HVQY
1. Khái niệm và vai trò sinh học của IL-6
1.1. Khái niệm về cytokin
Cytokin là một nhóm protein đa dạng không phải là kháng thể, chúng đóng vai trò là các chất trung gian giữa các tế bào. Trước hết chúng là sản phẩm của các tế bào miễn dịch, hoạt động như các chất trung gian và điều hòa các quá trình miễn dịch, nhưng đến hiện nay nhiều cytokin đã biết được sản xuất bởi các tế bào khác không phải là tế bào miễn dịch và cytokin cũng có tác dụng trên những tế bào không phải của hệ miễn dịch. Hiện nay cytokin đang được sử dụng trên lâm sàng như những chất sửa đổi đáp ứng sinh học để điều trị các rối loạn khác nhau. Các cytokin là một thuật ngữ chung được sử dụng để mô tả một nhóm lớn các protein, nhưng cũng có những thuật ngữ khác dùng để mô tả các loại cytokin đặc biệt, chúng bao gồm:
- Monokin là cytokin được sản xuất bởi các tế bào thực bào đơn nhân.
- Lymphokin là cytokin được sản xuất bởi tế bào lympho được hoạt hóa, đặc biệt là các tế bào Th.
- Interleukin là cytokin có vai trò trung gian giữa các bạch cầu.
- Chemokin là một phân tử nhỏ chủ yếu chịu trách nhiệm cho việc di chuyển bạch cầu.
Cytokin có chức năng như là một phần của hệ thống lớn hơn liên quan đến nhau của protein và thác tín hiệu, đó là mạng lưới cytokin. Đây là những tương tác phức tạp trong đó các tế bào khác nhau có thể phản ứng khác nhau đối với cùng một cytokin tùy thuộc vào các tín hiệu được tiếp nhận bởi tế bào. Tín hiệu cytokin rất linh hoạt và có thể gây ra cả hai phản ứng bảo vệ và làm hư hại. Một cytokin thường ảnh hưởng đến sự tổng hợp các cytokin khác. Chúng có thể tạo ra các thác, hoặc tăng cường hay ức chế sản xuất cytokin khác. Ngoài ra, chúng thường có thể ảnh hưởng đến hoạt động của các cytokin khác. Các hiệu ứng có thể là: đối kháng, phụ thêm, hoặc hiệp đồng.
Các cytokin thường không được lưu trữ như protein đã tạo ra từ trước. Thay vì sự tổng hợp của cytokin được bắt đầu bằng phiên mã gen và mRNA của chúng tồn tại ngắn ngủi. Chúng được sản xuất khi cần thiết trong phản ứng miễn dịch. Các gen mã hóa cho cytokin có thể sản xuất các biến thể thông qua việc cắt nối để tạo ra các protein hơi khác nhau nhưng có hoạt tính sinh học.
Nhiều cytokin được sản xuất bởi nhiều loại tế bào và tham gia vào cả hai đáp ứng miễn dịch tự nhiên và thu được. Các cytokin riêng rẽ cũng tác động lên nhiều loại tế bào và trong nhiều trường hợp cytokin có cùng hoạt tính (ví dụ, chúng bị thừa). Sự dư thừa là do bản chất của các thụ thể của cytokin.
1.2. Interleukin 6 (IL-6)
Interleukin 6 (IL-6) là một protein gồm 184 acid amin, có trọng lượng phân tử 20.781 dalton. IL-6 được tổng hợp từ các tế bào như đại thực bào phế nang, tế bào nội mô mạch máu, tế bào xơ non, tế nào tủy xương, tế bào sừng. IL-6 được tiết ra dưới sự kích thích của IL-1 và TNF alpha. Tại phổi sau khi được kích thích bởi khói thuốc lá thì tế bào biểu mô phế quản, tế bào cơ trơn phế quản cũng tổng hợp được IL-6. Bụi từ thức ăn gia súc cũng được chứng minh có khả năng kích thích tế bào biểu mô phế quản phóng thích IL-6 và IL-8. Rất nhiều loại tế bào có thể sản xuất IL-6, nhiều cytokin và những chất khác cảm ứng sự sản xuất IL-6, trong khi các glucocorticoid là những chất ức chế mạnh mẽ sự sản xuất IL-6. IL-6 cũng là một cytokine có hiệu lực tiền viêm, sản xuất bởi nhiều quần thể tế bào khác nhau, và tác động viêm bằng cách hoạt hoá tế bào bạch cầu và tế bào cấu trúc bao gồm tế bào biểu mô phổi. IL-6 là một phần trong đáp ứng pha cấp, và như là chất gây cảm ứng tế bào gan để sản xuất ra CRP. IL-6 được phóng thích trong đáp ứng với IL-1 và TNF-b. Thụ thể IL-6 được tìm thấy trên bề mặt của nhiều loại tế bào, bao gồm tế bào T còn lại, tế bào B hoạt hóa, dòng tế bào tủy, dòng tế bào gan.
Gen cấu trúc của IL-6 trên chromosom thứ 7 có trọng lượng phân tử là 22.000 - 30.000D.
IL-6 được sản xuất từ nhiều tế bào khác nhau: Tế bào T và B đã hoạt hoá, monocyt, tế bào nội mạc, tế bào gan, tế bào B bị nhiễm EBV, tế bào xơ non.
1.3. Vai trò sinh học của IL-6
IL-6 là cytokin có các hoạt tính sinh học đa dạng, nhưng chủ yếu làm tăng tổng hợp IL-1 và TNF để phối hợp kích thích đáp ứng miễn dịch, nhất là đáp ứng của gan trong giai đoạn đầu làm tăng sao chép, tăng biệt hoá, tăng tiết kháng thể của tế bào B, tăng phối hợp kích thích sinh máu và sản xuất thrombopoietin, kích thích phát triển tế bào gan và tế bào myeloma ở tổ chức nuôi cấy. Mới đầu IL-6 được coi là interferon - p2 (IFN-P2) vì chúng có hoạt tính chống virus và có kháng thể phản ứng chéo vói IFN, nhưng qua nhiều nghiên cứu người ta đã chứng minh rằng tự bản thân IL-6 không có tác dụng chống virus, tác dụng chống virus của IL-6 là kích thích sản xuất IFN.
IL-6 có một số tác dụng sinh học như tham gia vào đáp ứng miễn dịch ở giai đoạn đầu ở gan, sản xuất ra các yếu tố đề kháng không đặc hiệu giống như tác dụng của IL-1 và TNF, phát triển tế bào B và tương bào để tăng tạo kháng thể dịch thể, phối hợp với IL-1 và TNF có tác dụng làm tăng sản xuất IL-2. Tham gia với IL -1 và TNF kích thích phát triển tế bào xương, tế bào da, tham gia kích thích tạo máu. IL-6 có hai loại tác dụng chính: tham gia kích thích phát triển miễn dịch và kích thích tạo máu.
Interleukin-6 và phản ứng viêm: Một trong những vai trò chủ chốt của IL6 là như một cytokin chính khởi động đáp ứng pha cấp từ gan, điển hình ở chỗ tăng mạnh nồng độ trong 24 huyết tương của các protein pha cấp và là một dấu hiệu tiêu chuẩn của đáp ứng viêm cấp. Trong quá trình viêm IL6 hoạt động như một chất gây sốt nội sinh, tương tự như IL1 và TNF. IL6 là cytokin kích thích gan sản xuất protein viêm pha cấp như CRP, alpha - 1 antitrypsin, alpha - 2 macroglobulin cũng như lectin. Ngoài ra IL6 còn do lympho T CD4+ sản xuất và có ảnh hưởng quá trình chín của lympho B trở thành tương bào sản xuất kháng thể.
2. Vai trò của IL-6 trong bệnh sinh của viêm khớp dạng thấp
Khi kháng nguyên xâm nhập vào cơ thể sẽ được các tế bào trình diện kháng nguyên (đại thực bào, các tế bào đuôi gai, tế bào diệt tự nhiên) nhận biết, sau đó được trình diện cho các tế bào lympho T và B. Các tế bào lympho T CD4 (T help) được kích hoạt và sản xuất ra các lymphokin (Inteleukin-4, 10,13), các lymphokin này sẽ kích thích các tế bào lympho B tăng sinh và biệt hoá thành các tương bào và sản xuất ra các globulin miễn là các tự kháng thể.
Tại màng hoạt dịch khớp có tình trạng lắng đọng phức hợp miễn dịch kháng nguyên - kháng thể, do đó có tình trạng thực bào xuất hiện với sự hiện diện của các bạch cầu đa nhân trung tính, đại thực bào, tế bào mastocyt. Sau đó, chính các tế bào này lại tiết ra các cytokin khác như TNF-α, IL-1,2,6, interferon, yếu tố phát triển nội mạc mạch máu (VEGF) và các yếu tố hoá ứng động khác tạo vòng xoắn bệnh lý thúc đẩy quá trình viêm. Sự tăng sinh mạch dưới tác dụng của VEGF cùng sự xâm nhập một loạt các tế bào viêm khác hình thành nên màng mạch (mảng pannus). Mảng pannus xâm lấn vào đầu xương, sụn khớp và các enzym tiêu huỷ tổ chức do các tế bào viêm giải phóng như stromelysin, elastase, collagenase... cùng sự xâm nhập các nguyên bào xơ gây phá huỷ khớp, dính khớp và hậu quả là tàn tật. Như vậy có sự tham gia của cả miễn dịch dịch thể (tạo thành phức hợp miễn dịch) và miễn dịch tế bào (giải phóng ra các cytokin thực hiện phản ứng viêm và phá hủy khớp), trong đó lympho T đóng vai trò trung tâm. Dựa trên sự hiểu biết về cơ chế bệnh sinh này, các nhà khoa học đã nghiên cứu ra các thuốc kích hoạt hoặc sửa chữa hệ miễn dịch thông qua ức chế từng loại tế bào, từng loại cytokin để khống chế tình trạng viêm của bệnh.
IL-6 là một protein do cơ thể sản sinh ra trong phản ứng của cơ thể với tình trạng viêm, chấn thương. IL-6 thúc đẩy hiện tượng viêm như sưng, nóng, đỏ, đau và phản ứng toàn thân như sốt. Chất này đặc biệt có vai trò quan trong trong cơ chế bệnh sinh của một số bệnh như viêm khớp dạng thấp, viêm cột sống dính khớp, thấp khớp vẩy nến, bệnh Crohn.
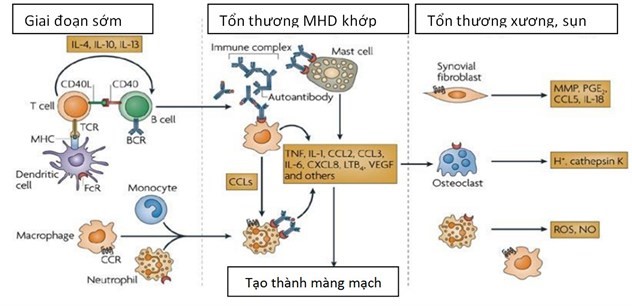
Hình 1. Cơ chế bệnh sinh viêm khớp dạng thấp.
3. Thuốc sinh học Actemra ức chế IL-6 trong điều trị viêm khớp dạng thấp
3.1. Khái niệm về thuốc sinh học điều trị viêm khớp dạng thấp
Đây là các loại protein được biến đổi gen, để nhắm vào một bước trong hệ thống miễn dịch chống viêm và cải thiện các triệu chứng viêm khớp.
Có một số loại thuốc sinh học khác nhau có thể được sử dụng để điều trị viêm khớp dạng thấp, chẳng hạn như:
- Chất ức chế tế bào B: Các loại thuốc này ảnh hưởng đến tế bào B, là các tế bào bạch cầu, mang một loại protein có thể kích hoạt hệ thống miễn dịch.
- Thuốc chẹn Interleukin - 1 (IL-1): Thuốc này có thể ức chế quá trình sản xuất các chất gây viêm mà cơ thể tạo ra.
- Thuốc chẹn Interleukin - 6 (IL-6) hoặc thuốc chẹn interleukin - 17: Thuốc có tác dụng ngăn chặn các hóa chất gây viêm kết nối vào các tế bào.
- Chất ức chế tế bào T: Thuốc có thể ngăn chặn giao tiếp giữa các tế bào T, một loại tế bào bạch cầu có thể gây viêm trong cơ thể.
- Chất ức chế Janus kinase (JAK): Thuốc hoạt động bằng cách ngăn chặn các protein kích hoạt quá trình viêm trong cơ thể.
- Chất ức chế yếu tố hoại tử khối u (TNF): Thuốc có thể ngăn chặn một chất hóa học mà cơ thể tạo ra để thúc đẩy quá trình viêm.
Thuốc sinh học có thể làm chậm tiến triển của viêm khớp dạng thấp, tuy nhiên không thể điều trị dứt điểm bệnh. Ngoài ra, thuốc cũng mang lại nhiều tác dụng phụ hơn các phương pháp điều trị khác. Do đó, thuốc sinh học thường được chỉ định khi các phương pháp khác, chẳng hạn như NSAID truyền thống (như ibuprofen) hoặc DMARD (như methotrexate) không hiệu quả.
6.2. Thuốc sinh học Actemra (Tocilizumab) kháng thụ thể interleukin-6
- Thành phần: Mỗi ml có chứa Tocilizumab 20mg do hãng Roche sản xuất, lọ 10ml chứa 200mg.
- Liều dung: 4 mg/kg và 8 mg/kg truyền tĩnh mạch một giờ mỗi 4 tuần trong 24 tuần.
- Cơ chế tác dụng:
Tocilizumab là kháng thể đơn dòng tái tổ hợp có tác dụng kháng thụ thể interleukin-6 (IL-6) ở người là thành phần của phân nhóm globulin miễn dịch (Ig) IgG1. Tocilizumab gắn chuyên biệt với cả phần thụ thể gắn kết hòa tan và thụ thể gắn kết màng của IL-6 (sIL-6R, mIL-6R), và đã cho thấy ức chế được tín hiệu điều hòa bởi sIL-6R và mIL-6R. IL-6 là cytokine đa chức năng, được sản xuất bởi nhiều loại tế bào liên quan đến chức năng cận tiết tại chỗ cũng như sự điều hòa của các tiến trình bệnh học và sinh lý học của cơ thể như sự kích thích tiết ra globulin miễn dịch, hoạt hóa tế bào T, kích thích các protein giai đoạn cấp của gan và kích thích tiến trình tạo máu. IL-6 có liên quan đến bệnh sinh của các bệnh bao gồm bệnh lý viêm, loãng xương và ung thư. Sự tồn tại của tocilizumab giúp bảo vệ vật chủ chống lại nhiễm trùng và bệnh lý ác tính. Vai trò của thụ thể IL-6 trong việc ức chế sự phát triển của khối u ác tính hiện chưa được biết.
- Dược lực học:
IL-6 làm giảm nhanh chóng C-reactive protein (CRP), tốc độ máu lắng (ESR) và amyloid A huyết thanh (SAA). Làm tăng nồng độ hemoglobin, qua việc Tocilizumab làm giảm tác động chi phối bởi IL-6 lên sự sản xuất hepcidin để làm tăng tạo sắt. Ở người khỏe mạnh dùng tocilizumab liều 2-28 mg/kg, số lượng tuyệt đối bạch cầu trung tính giảm xuống mức thấp nhất từ 3 đến 5 ngày sau khi truyền. Sau đó, bạch cầu trung tính phục hồi về mức ban đầu theo cách phụ thuộc vào liều. Các bệnh nhân viêm khớp dạng thấp biểu hiện một kiểu thay đổi số lượng tuyệt đối bạch cầu trung tính sau khi truyền tocilizumab tương tự nhau.
- Dược động học:
Dược động học của Tocilizumab được xác định bằng phân tích dược động học dân số trên bộ dữ liệu bao gồm 1793 bệnh nhân viêm khớp dạng thấp điều trị với 4 mg/kg và 8 mg/kg truyền tĩnh mạch một giờ mỗi 4 tuần trong 24 tuần.
Các thông số dược động học của Tocilizumab không thay đổi theo thời gian. Khi dùng liều 4 mg/kg và 8 mg/kg mỗi 4 tuần, diện tích dưới đường cong (AUC) và nồng độ đáy (Cmin) tăng nhiều hơn mức tỷ lệ với liều. Nồng độ tối đa (Cmax) tăng theo tỉ lệ theo liều. Ở trạng thái ổn định, AUC và Cmin lần lượt tăng cao hơn 2,7 và 6,5 lần ở liều 8 mg/kg so với liều 4 mg/kg.
Viêm khớp thiếu niên tự phát thể đa khớp: Dược động học của tocilizumab được xác định bằng phân tích dược động học dân số trên bộ dữ liệu bao gồm 188 bệnh nhân viêm đa khớp vô căn khởi phát ở trẻ em. Các thông số sau đây có hiệu lực với liều tocilizumab 8 mg/kg (bệnh nhân có trọng lượng cơ thể ≥ 30kg) dùng mỗi 4 tuần. Giá trị trung bình dự kiến (± SD) của AUC 4 tuần, Cmax và Cmin của tocilizumab lần lượt là 29500±8660 mcg•giờ/ml, 182±37 mcg/ml và 7,49±8,2 mcg/ml.
Viêm khớp thiếu niên tự phát thể hệ thống: Dược động học của tocilizumab được xác định bằng phân tích dược động học dân số trên bộ dữ liệu bao gồm 75 bệnh nhân viêm khớp vô căn khởi phát ở trẻ em một cách có hệ thống điều trị bằng 8 mg/kg (bệnh nhân có trọng lượng cơ thể ≥ 30kg) hoặc 12 mg/kg (bệnh nhân có trọng lượng cơ thể < 30kg), truyền tĩnh mạch mỗi 2 tuần. Giá trị trung bình dự kiến (± SD) của AUC2 tuần, Cmax và Cmin của tocilizumab lần lượt là 32200±9960 giờ·µg/ml, 245±57,2 µg/ml, và 57,5±23,3 µg/ml. Tỉ số tích lũy của Cmin (tuần 12/tuần 2) là 3,2±1,3. Cmin tocilizumab ổn định sau tuần thứ 12. Các thông số hấp thu tocilizumab trung bình dự kiến tương tự nhau giữa hai nhóm cân nặng.
- Phân bố:
Sau khi truyền tĩnh mạch, Actemra qua thải trừ 2 pha từ vòng tuần hoàn. Ở bệnh nhân viêm khớp dạng thấp thể tích phân bố trung tâm là 3,5 L, thể tích phân bố ngoại biên là 2,9 L, dẫn đến thể tích phân bố ở trạng thái ổn định là 6,4 L.
Ở bệnh nhân nhi mắc sJIA (viêm khớp tự phát thiếu niên thể hệ thống), thể tích phân bố trung tâm là 0,94 L, thể tích phân bố ngoại biên là 1,60 L, dẫn đến thể tích phân bố ở trạng thái ổn định là 2,54 L.
- Đào thải:
T1/2 của tocilizumab phụ thuộc nồng độ ở bệnh nhân viêm khớp dạng thấp. Ở trạng thái ổn định, bệnh nhân viêm khớp dạng thấp, t1/2 biểu kiến phụ thuộc nồng độ là 11 ngày với liều 4 mg/kg và 13 ngày với liều 8 mg/kg 4 tuần một lần.
T1/2 của tocilizumab ở trẻ em mắc pJIA (viêm khớp tự phát thiếu niên thể đa khớp) là 16 ngày với cả hai nhóm cân nặng (8 mg/kg với trọng lượng ≥ 30kg hoặc 10 mg/kg với trọng lượng < 30kg) trong suốt một khoảng liều ở trạng thái ổn định.
T1/2 của tocilizumab ở trẻ em mắc sJIA (viêm khớp tự phát thiếu niên thể hệ thống) là 23 ngày với cả hai nhóm cân nặng (8 mg/kg với trọng lượng ≥ 30kg hoặc 12 mg/kg với trọng lượng < 30kg) ở tuần thứ 12.
- Dược động học ở dân số đặc biệt:
Suy gan: Chưa có nghiên cứu chính thức nào được tiến hành ảnh hưởng của suy gan lên dược động học của Actemra.
Suy thận: Chưa có nghiên cứu chính thức nào được tiến hành ảnh hưởng của suy thận lên dược động học của Actemra. Hầu hết các bệnh nhân trong phân tích dược động học dân số có chức năng thận bình thường hoặc suy thận nhẹ. Suy thận nhẹ (thanh thải creatinine tính theo Cockcroft-Gault < 80ml/phút và ≥ 50ml/phút) không ảnh hưởng dược động học của Actemra. Không đòi hỏi phải điều chỉnh liều cho bệnh nhân suy thận nhẹ.
Các đối tượng đặc biệt khác: Phân tích dược động học dân số ở những bệnh nhân viêm khớp dạng thấp người lớn cho thấy tuổi tác, giới tính và chủng tộc không ảnh hưởng đến dược động học của tocilizumab. Không cần thiết điều chỉnh liều cho các yếu tố nhân khẩu học.
- An toàn tiền lâm sàng:
+ Khả năng sinh ung thư: Nghiên cứu về khả năng sinh ung của Actemra chưa được tiến hành. Dữ liệu tiền lâm sàng hiện tại cho thấy sự góp phần của cytokine IL-6 đa tác dụng vào sự tiến triển ác tính và đề kháng với chết tế bào theo lập trình của nhiều loại ung thư. Những dữ liệu này không gợi ý có nguy cơ liên quan với khởi phát tiến triển ung thư sau khi điều trị với Actemra. Phù hợp với điểm vừa nêu các tổn thương tăng sinh chưa được ghi nhận trong một nghiên cứu độc tính kéo dài 6 tháng ở khỉ đầu chó cũng như không thấy mô tả trong chuột bất hoạt IL-6 trong điều kiện làm giảm IL-6 mạn tính.
+ Khả năng đột biến gen: Nghiên cứu về độc tính di truyền chuẩn với Tocilizumab trên các tế bào của sinh vật có nhân và không nhân điển hình đều cho kết quả âm tính.
+ Giảm khả năng sinh sản: Các dữ liệu tiền lâm sàng hiện có không gợi ý cho thấy có ảnh hưởng khả năng sinh sản khi điều trị với một chất tương tự Tocilizumab. Ảnh hưởng trên cơ quan hoạt động nội tiết hoặc các cơ quan của hệ sinh sản đã không được ghi nhận trong một nghiên cứu độc tính kéo dài của khỉ đầu chó, cũng không thấy ảnh hưởng trên khả năng sinh sản của chuột thiếu IL-6.
+ Khả năng sinh dị dạng thai: Khi truyền Actemra tĩnh mạch vào loài khỉ đầu chó trong giai đoạn sớm thai kỳ, không ghi nhận có ảnh hưởng có hại trực tiếp, hoặc gián tiếp lên thai kỳ hoặc sự phát triển của phôi thai.
+ Đặc tính khác về an toàn: Một nghiên cứu độc tính trên phôi thai tiến hành trên khỉ đầu chó ghi nhận có tăng nhẹ tình trạng chết phôi thai/sảy thai với nồng độ phơi nhiễm cộng dồn toàn thân cao (> 100 lần nồng độ phơi nhiễn ở người) ở nhóm liều cao 50 mg/kg/ngày so với giả dược và các nhóm liều thấp khác. Tỷ lệ sảy thai ở khỉ đầu chó trong điều kiện nuôi nhốt và các trường hợp riêng chết phôi thai/sảy thai đã không cho thấy bất kỳ mối liên quan nào với việc dùng hoặc thời gian dùng tocilizumab. Mặc dù IL-6 dường như không là cytokine chính cho cả sự phát triển thai hoặc kiểm soát miễn dịch của mẹ/bào thai, mối liên hệ của phát hiện này với Tocilizumab không thể loại trừ.
Sự vận chuyển của một chất tương đồng ở chuột của tocilizumab vào sữa của những con chuột cho con bú đã được quan sát.
Điều trị với một chất tương đồng ở chuột không gây độc tính ở chuột trưởng thành. Đặc biệt, không gây suy giảm sự phát triển của hệ xương, chức năng miễn dịch và sự hoàn thiện chức năng sinh sản.
Không có sự khác nhau về độc tính ngoài lâm sàng của tocilizumab trên khỉ đuôi dài khi dùng dạng tiêm dưới da và truyền tĩnh mạch.
- Chỉ định/Công dụng:
+ Viêm khớp dạng thấp (RA): Tocilizumab, phối hợp với Methotrexate (MTX), được chỉ định cho điều trị bệnh viêm khớp dạng thấp (RA) tiến triển từ trung bình đến nặng ở bệnh nhân trưởng thành đáp ứng không đầy đủ hoặc không dung nạp với điều trị trước đó bằng một hoặc nhiều thuốc chống thấp khớp cải thiện bệnh (DMARDs) hoặc chất chống yếu tố hoại tử khối u (TNF). Ở những bệnh nhân này, Actemra có thể được dùng đơn trị trong trường hợp không dung nạp với MTX hoặc việc tiếp tục điều trị với MTX là không phù hợp.
+ Viêm khớp thiếu niên tự phát thể đa khớp (pJIA: paediatric Juveline idiopathic arthritis): Tocilizumab được chỉ định cho điều trị bệnh viêm khớp thiếu niên tự phát thể đa khớp ở bệnh nhân từ hai tuổi trở lên, không đáp ứng đầy đủ với điều trị bằng methotrexat trước đó. Actemra cũng có thể được chỉ định đơn trị trong trường hợp không dung nạp với methotrexat hoặc việc tiếp tục điều trị bằng methotrexat không còn thích hợp.
+ Viêm khớp thiếu niên tự phát thể hệ thống (sJIA: systemic juvenile idiopathic arthritis): Tocilizumab được chỉ định cho điều trị bệnh viêm khớp thiếu niên tự phát thể hệ thống ở trẻ em từ hai tuổi trở lên, không đáp ứng với các thuốc chống viêm không steroid NSAIDs và corticoid toàn thân. Tocilizumab có thể được dùng đơn trị (trong trường hợp không dung nạp với MTX hoặc việc tiếp tục điều trị với MTX là không phù hợp) hoặc phối hợp với MTX.
- Liều lượng & Cách dùng:
+ Liều tiêm tĩnh mạch được đề nghị:
Liều khuyến cáo của thuốc cho bệnh nhân trưởng thành khi truyền tĩnh mạch nhỏ giọt trong 60 phút là 4 mg/ mỗi kg mỗi 4 tuần sau đó tăng lên 8 mg / mỗi kg mỗi 4 tuần dựa trên đáp ứng lâm sàng.
+ Viêm khớp thiếu niên tự phát thể đa khớp (pJIA):
Liều khuyến cáo của Tocilizumab cho bệnh nhân viêm khớp thiếu niên tự phát thể đa khớp là:
10 mg/kg cho bệnh nhân < 30 kilogram (kg),
8 mg/kg cho bệnh nhân ≥ 30 kilogram (kg),
dùng mỗi 4 tuần bằng cách truyền tĩnh mạch. Sự thay đổi liều chỉ được dựa trên sự thay đổi trọng lượng cơ thể theo thời gian. Tocilizumab có thể dùng đơn trị hoặc kết hợp với MTX.
+ Viêm khớp thiếu niên tự phát thể hệ thống (sJIA: systemic juvenile idiopathic arthritis):
Liều khuyến cáo của Tocilizumab cho bệnh nhân viêm khớp thiếu niên tự phát thể hệ thống là:
12 mg/kg cho bệnh nhân < 30 kilogram (kg),
8 mg/kg cho bệnh nhân ≥ 30 kilogram (kg),
dùng mỗi 2 tuần bằng cách truyền tĩnh mạch. Sự thay đổi liều chỉ được dựa trên sự thay đổi trọng lượng cơ thể theo thời gian. Tocilizumab có thể dùng đơn trị hoặc kết hợp với MTX.
+ Viêm động mạch tế bào khổng lồ (GCA):
Liều được khuyến nghị cho bệnh nhân trưởng thành mắc GCA là 162 mg mỗi tuần một lần dưới dạng tiêm dưới da kết hợp với một liệu trình glucocorticoids giảm dần.
Một liều 162 mg được tiêm mỗi tuần một lần dưới dạng tiêm dưới da kết hợp với một liệu trình glucocorticoids giảm dần có thể được chỉ định dựa trên các cân nhắc lâm sàng.
+ Điều chỉnh liều được khuyến cáo căn cứ vào các kết quả xét nghiệm như sau:
Các bất thường về men gan:

Số lượng tuyệt đối bạch cầu trung tính (ANC) thấp:

Số lượng tiểu cầu thấp:

+ Viêm khớp thiếu niên tự phát thể đa khớp (pJIA): Liều khuyến cáo của Tocilizumab cho bệnh nhân viêm khớp thiếu niên tự phát thể đa khớp là:
10 mg/kg cho bệnh nhân < 30 kilogram (kg),
8 mg/kg cho bệnh nhân ≥ 30 kilogram (kg),
dùng mỗi 4 tuần bằng cách truyền tĩnh mạch. Sự thay đổi liều chỉ được dựa trên sự thay đổi trọng lượng cơ thể theo thời gian. Tocilizumab có thể dùng đơn trị hoặc kết hợp với MTX.
+ Viêm khớp thiếu niên tự phát thể hệ thống (sJIA): Liều khuyến cáo của Tocilizumab cho bệnh nhân viêm khớp thiếu niên tự phát thể hệ thống là:
12 mg/kg cho bệnh nhân < 30 kilogram (kg),
8 mg/kg cho bệnh nhân ≥ 30 kilogram (kg),
Dùng mỗi 2 tuần bằng cách truyền tĩnh mạch. Sự thay đổi liều chỉ được dựa trên sự thay đổi trọng lượng cơ thể theo thời gian. Tocilizumab có thể dùng đơn trị hoặc kết hợp với MTX.
Các hướng dẫn điều chỉnh liều cho pJIA và sJIA: Việc giảm liều tocilizumab chưa được nghiên cứu trong nhóm bệnh nhân viêm khớp thiếu niên tự phát thể đa khớp hoặc viêm khớp thiếu niên tự phát thể hệ thống. Ngừng dùng tocilizumab khi có các bất thường cận lâm sàng được khuyến cáo ở những bệnh nhân viêm đa khớp hoặc viêm khớp thiếu niên tự phát thể hệ thống và tương tự như những phần đã trình bày ở trên cho bệnh nhân viêm khớp dạng thấp (xem "Các xét nghiệm"). Nếu có thể, nên điều chỉnh liều hoặc chấm dứt dùng methotrexate và/hoặc các thuốc dùng đồng thời và ngừng dùng tocilizumab cho đến khi tình trạng lâm sàng được đánh giá. Với bệnh viêm đa khớp vô căn khởi phát ở trẻ em hoặc viêm khớp thiếu niên tự phát thể hệ thống, việc quyết định không dùng tocilizumab do các dấu hiệu bất thường cận lâm sàng cần dựa trên đánh giá của các chuyên gia y tế trên từng bệnh nhân.
- Các hướng dẫn liều dùng đặc biệt:
Trẻ em: Tính an toàn và hiệu quả của Tocilizumab ở trẻ em ở các tình trạng khác với pJIA hoặc sJIA chưa được xác lập. Chưa có nghiên cứu trên trẻ em dưới 2 tuổi.
Người già: Ở những bệnh nhân trên 65 tuổi không cần chỉnh liều.
Suy thận: Không cần điều chỉnh liều ở những bệnh nhân suy thận nhẹ (xem Dược động học ở dân số đặc biệt). Tocilizumab chưa được nghiên cứu ở bệnh nhân suy thận mức độ trung bình đến nặng.
Suy gan: Tính an toàn và hiệu quả của Tocilizumab chưa được nghiên cứu ở bệnh nhân suy gan (xemCảnh báo).
- Hướng dẫn đặc biệt cho sử dụng:
Viêm khớp dạng thấp: Từ một túi truyền 100 ml, rút ra một lượng dung dịch nước muối sinh lý 0,9% bằng lượng dung dịch tocilizumab cần thiết tương ứng với liều của bệnh nhân. Rút lượng thuốc tocilizumab cần thiết (0,4 ml/kg) dưới điều kiện vô trùng và pha loãng đến nồng độ tocilizumab đã tính toán trong túi dịch truyền 100 ml chứa dung dịch nước muối sinh lý 0,9% vô trùng không chất gây sốt. Để trộn dung dịch, nhẹ nhàng đảo ngược túi dung dịch đã pha để tránh tạo bọt.
Bệnh nhân sJIA và pJIA ≥ 30kg: Từ một túi truyền 100 ml, rút ra một lượng dung dịch nước muối sinh lý 0,9% bằng lượng dung dịch tocilizumab cần thiết tương ứng với liều của bệnh nhân. Rút lượng thuốc tocilizumab cần thiết (0,4 ml/kg) dưới điều kiện vô trùng và pha loãng đến nồng độ tocilizumab đã tính toán trong túi dịch truyền 100 ml chứa dung dịch nước muối sinh lý 0,9% vô trùng không chất gây sốt. Để trộn dung dịch, nhẹ nhàng đảo ngược túi dung dịch đã pha để tránh tạo bọt.
Bệnh nhân pJIA < 30kg: Từ một túi truyền 50 ml, rút ra một lượng dung dịch nước muối sinh lý 0,9% tương đương với 0.5 ml/kg trọng lượng cơ thể bệnh nhân và bỏ đi. Thể tích này được thay thế trong các túi nước muối có thể tích dung dịch tocilizumab tương đương dưới điều kiện vô trùng. Để trộn dung dịch, nhẹ nhàng đảo ngược túi dung dịch đã pha để tránh tạo bọt.
Bệnh nhân sJIA < 30kg: Từ một túi truyền 50 ml, rút ra một lượng dung dịch nước muối sinh lý 0,9% tương đương với 0.6 ml/kg trọng lượng cơ thể bệnh nhân và bỏ đi. Thể tích này được thay thế trong các túi nước muối có thể tích dung dịch tocilizumab tương đương dưới điều kiện vô trùng. Để trộn dung dịch, nhẹ nhàng đảo ngược túi dung dịch đã pha để tránh tạo bọt.
- Cảnh báo:
Cảnh báo và thận trọng chung: Để cải thiện việc truy xuất nguồn gốc của các thuốc sinh học, tên thương mại của các thuốc được chỉ định cần được ghi rõ ràng (hoặc ghi) trong hồ sơ bệnh nhân.
+ Nhiễm trùng: Các nhiễm trùng nặng và đôi khi gây tử vong đã được báo cáo ở những bệnh nhân dùng các tác nhân ức chế miễn dịch bao gồm cả tocilizumab (xem Tác dụng ngoại ý). Không nên khởi đầu điều trị Actemra ở những bệnh nhân nhiễm trùng tiến triển. Nếu bệnh nhân bị nhiễm trùng nặng nên tạm ngừng truyền Actemra cho đến khi tình trạng nhiễm trùng được kiểm soát. Các bác sĩ điều trị nên thận trọng khi cân nhắc sử dụng Actemra ở bệnh nhân có tiền sử nhiễm trùng tái phát hoặc những điều kiện sẵn có (như viêm túi thừa, đái tháo đường) có thể làm cho bệnh nhân dễ bị nhiễm trùng.
Khuyến cáo theo dõi chặt để phát hiện kịp thời nhiễm trùng nặng ở những bệnh nhân bị RA, pJIA hoặc sJIA từ trung bình đến nặng điều trị với các thuốc sinh học vì các dấu hiệu và triệu chứng của viêm cấp có thể được giảm bớt, liên quan đến sự ức chế của các chất phản ứng giai đoạn cấp. Nên hướng dẫn bệnh nhân và cha mẹ/người giám hộ của trẻ vị thành niên mắc pJIA hoặc sJIA lập tức liên hệ với các chuyên gia y tế khi có bất kỳ dấu hiệu nào cho thấy nhiễm trùng xuất hiện để đảm bảo đánh giá nhanh chóng và điều trị thích hợp.
+ Các biến chứng của viêm túi thừa: Biến chứng của viêm túi thừa như các biến cố thủng túi thừa đã được báo cáo ở các bệnh nhân viêm khớp dạng thấp. Tocilizumab nên được sử dụng thận trọng ở những bệnh nhân có tiền sử loét ruột hoặc viêm túi thừa. Bệnh nhân thể hiện các triệu chứng có khả năng dẫn tới biến chứng của viêm túi thừa phức tạp, như đau bụng, nên được đánh giá kịp thời để xác định sớm thủng tiêu hóa.
+ Bệnh lao: Khuyến cáo giống như các liệu pháp sinh học khác trong điều trị viêm khớp dạng thấp, , pJIA hoặc sJIA, bệnh nhân nên được sàng lọc bệnh lao tiềm ẩn trước khi bắt đầu điều trị tocilizumab. Bệnh nhân có bệnh lao tiềm ẩn cần được điều trị bằng liệu pháp kháng vi khuẩn lao chuẩn trước khi bắt đầu tocilizumab.
+ Hoạt hóa vi rút: Hoạt hóa vi rút (ví dụ như vi rút viêm gan B) đã được báo cáo khi điều trị viêm khớp dạng thấp bằng các thuốc sinh học. Trong các nghiên cứu lâm sàng với tocilizumab, những bệnh nhân qua sàng lọc thấy dương tính với viêm gan đều được loại trừ.
+ Tiêm chủng: Không nên dùng vắc xin sống và bất hoạt đồng thời với Actemra vì tính an toàn lâm sàng chưa được xác lập.
Hiện tại chưa có dữ liệu việc truyền nhiễm thứ phát từ người được tiêm vắc xin sống cho bệnh nhân điều trị bằng Actemra. Trong một nghiên cứu mở ngẫu nhiên, các bệnh nhân viêm khớp dạng thấp người lớn điều trị bằng tocilizumab và MTX có thể cộng gộp một phản ứng hiệu quả cho cả polysaccharide phế cầu khuẩn hóa trị 23 và vắc-xin độc tố - uốn ván mà có thể so sánh với phản ứng ở các bệnh nhân chỉ điều trị MTX.
Khuyến nghị tất cả các bệnh nhân, đặc biệt là bệnh nhân viêm khớp thiếu niên tự phát thể đa khớp hoặc viêm khớp thiếu niên tự phát thể hệ thống, nếu có thể, nên tiêm tất cả các chủng ngừa theo đúng các hướng dẫn tiêm chủng hiện hành trước khi bắt đầu điều trị tocilizumab. Khoảng cách giữa tiêm vắc xin sống và bắt đầu điều trị tocilizumab nên được tuân theo hướng dẫn tiêm chủng hiện hành đối với các tác nhân ức chế miễn dịch.
+ Phản ứng quá mẫn: Các phản ứng quá mẫn nặng, trong đó có cả sốc phản vệ dẫn đến tử vong đã được báo cáo là có liên quan đến truyền Tocilizumab. Trong các biến cố theo dõi sau khi thuốc lưu hành, phản ứng quá mẫn nặng và sốc phản vệ, trong đó có vài trường hợp tử vong, đã xảy ra ở những bệnh nhân điều trị một khoảng liều tocilizumab, dùng cùng hoặc không cùng với các liệu pháp điều trị viêm khớp, thuốc tiền mê, và/hoặc có phản ứng quá mẫn. Những biến cố này xảy ra sớm nhất là vào lần truyền liều tocilizumab đầu tiên. Nên có sẵn điều trị thích hợp để sử dụng ngay lập tức trong trường hợp có phản ứng phản vệ trong quá trình dùng Actemra. Nếu xảy ra phản ứng dị ứng hoặc các phản ứng quá mẫn nghiêm trọng khác, nên dừng sử dụng tocilizumab ngay lập tức và tocilizumab nên được chấm dứt vĩnh viễn.
+ Bệnh gan tiến triển và suy gan: Điều trị với Actemra đặc biệt khi dùng đồng thời với MTX, có thể kết hợp với tăng transaminases gan. Do đó cần thận trọng khi cân nhắc điều trị cho bệnh nhân có bệnh gan tiến triển hoặc suy gan.
+ Khối u ác tính: Nguy cơ gặp khối u ác tính tăng ở những bệnh nhân viêm khớp dạng thấp. Các thuốc điều hòa miễn dịch có thể làm tăng nguy cơ mắc khối u ác tính.
+ Nguy cơ tim mạch: Tăng nguy cơ rối loạn tim mạch trên những bệnh nhân viêm khớp dạng thấp. Việc kiểm soát các yếu tố nguy cơ (như tăng huyết áp, tăng lipid máu) trên nhóm bệnh nhân này nên được tiến hành thường quy trong chế độ theo dõi, chăm sóc.
+ Phối hợp với các chất đối kháng TNF: Chưa có kinh nghiệm trong việc điều trị Actemra cùng với các chất đối kháng TNF hoặc các thuốc sinh học khác để điều trị cho các bệnh nhân viêm khớp dạng thấp tự phát hệ thống thanh thiếu niên - sJIA (systemic juvenile idiopathic arthritis) và viêm khớp dạng thấp tự phát trẻ em - pJIA (paediatric Juveline idiopathic arthritis).
Không nên điều trị Actemra với các thuốc sinh học khác.
Natri: Actemra chứa 1,17mmol (hoặc 26,55mg) natri trên liều tối đa 1200mg. Cần cân nhắc điều trị đối với những bệnh nhân đang theo chế độ ăn kiểm soát natri. Liều Actemra dưới 1025mg chứa lượng natri ít hơn 1mmol (23mg), không natri.
+ Các rối loạn khử hóa myelin: Các bác sĩ nên cảnh giác với các triệu chứng có khả năng biểu hiện của rối loạn hủy myelin trung tâm mới khởi phát. Khả năng hủy myelin trung tâm với tocilizumab hiện vẫn chưa biết.
- Viêm khớp thiếu niên tự phát thể hệ thống - pJIA (paediatric Juveline idiopathic arthritis).:
Hội chứng hoạt hóa đại thực bào (MAS): MAS là một chứng bệnh nghiêm trọng đe dọa cuộc sống có thể phát triển ở những bệnh nhân sJIA. Trong các thử nghiệm lâm sàng, tocilizumab chưa được nghiên cứu ở những bệnh nhân MAS trong giai đoạn tiến triển.
Tính lệ thuộc và lạm dụng thuốc: Chưa có nghiên cứu về tác động của Actemra gây lệ thuộc thuốc được tiến hành. Tuy nhiên, hiện tại không có bằng chứng cho thấy điều trị Actemra gây lệ thuộc thuốc.
Khả năng lái xe và vận hành máy móc: Không có nghiên cứu trình bày về tác động của Actemra lên khả năng lái xe và vận hành máy móc. Tuy nhiên, hiện tại không có bằng chứng điều trị Actemra ảnh hưởng lên khả năng lái xe và vận hành máy móc.
- Các xét nghiệm:
Viêm khớp dạng thấp, viêm khớp thiếu niên tự phát thể đa khớp và viêm khớp thiếu niên tự phát thể hệ thống
+ Giảm bạch cầu đa nhân trung tính: Điều trị bằng Tocilizumab thường làm tăng tỷ lệ giảm bạch cầu trung tính. Việc giảm bạch cầu trung tính do điều trị không liên quan đến các nhiễm trùng nghiêm trọng trong các thử nghiệm lâm sàng.
Nên thận trọng khi cân nhắc khởi đầu điều trị Actemra ở các bệnh nhân có số lượng bạch cầu trung tính thấp chẳng hạn như số lượng tuyệt đối bạch cầu trung tính (ANC) < 2×109/l. Không khuyến cáo điều trị ở những bệnh nhân có số lượng bạch cầu trung tính tuyệt đối < 0,5×109/l.
Cần kiểm tra bạch cầu trung tính ở bệnh nhân viêm khớp dạng thấp 4 đến 8 tuần sau khi bắt đầu điều trị và sau đó tuân thủ theo hướng dẫn thực hành lâm sàng tốt. Việc khuyến cáo điều chỉnh liều dựa trên kết quả bạch cầu trung tính ANC.
Ở bệnh nhân pJIA và sJIA: Cần kiểm soát số lượng bạch cầu trung tính tại thời điểm truyền thứ hai và sau đó theo hướng dẫn thực hành lâm sàng tốt.
+ Giảm tiểu cầu: Điều trị bằng tocilizumab có liên quan với tỷ lệ cao hơn sự giảm số lượng tiểu cầu. Giảm tiểu cầu do điều trị không dẫn tới chảy máu nghiêm trọng trong các thử nghiệm lâm sàng.
Cần thận trọng khi cân nhắc bắt đầu điều trị tocilizumab ở bệnh nhân có lượng tiểu cầu dưới 100×103/μl. Ở bệnh nhân có số lượng tiểu cầu < 50×103/μL thì không nên điều trị.
Ở bệnh nhân viêm khớp dạng thấp, tiểu cầu cần được theo dõi 4-8 tuần sau khi bắt đầu điều trị và sau đó theo thực hành lâm sàng tốt. Khuyến cáo chỉnh liều dựa trên số lượng tiểu cầu.
Ở bệnh nhân pJIA và sJIA: Cần kiểm soát số lượng tiểu cầu tại thời điểm truyền thứ hai và sau đó theo hướng dẫn thực hành lâm sàng tốt.
+ Tăng men gan: Trong các thử nghiệm lâm sàng, tăng men gan nhẹ và vừa đã được ghi nhận khi điều trị bằng tocilizumab, không có sự tiến triển dẫn tới tổn thương gan. Tần số tăng men gan tăng lên đã được ghi nhận khi dùng tocilizumab kết hợp với các thuốc gây độc trên gan (ví dụ methotrexate (MTX)).
Cần thận trọng khi cân nhắc bắt đầu điều trị bằng tocilizumab ở bệnh nhân có ALT hoặc AST > 1,5×ULN.
Không khuyến cáo điều trị ở bệnh nhân có ALT hoặc AST > 5ULN.
Cần kiểm tra ALT và AST ở bệnh nhân RA thời điểm 4 tới 8 tuần sau khi khởi đầu điều trị và sau đó theo hướng dẫn thực hành lâm sàng tốt.
Khuyến cáo điều chỉnh liều dựa trên men gan.
Ở bệnh nhân pJIA và sJIA, cần kiểm tra ALT và AST tại thời điểm truyền thứ hai và sau đó theo hướng dẫn thực hành lâm sàng tốt.
+ Các thông số lipid: Việc tăng các thông số lipid như cholesterol toàn phần, triglycerides và/hoặc cholesterol lipoprotein tỉ trọng thấp (LDL) đã được ghi nhận.
Cần đánh giá các thông số lipid của các bệnh nhân RA, pJIA và sJIA ở thời điểm 4 tới 8 tuần sau khi bắt đầu điều trị với tocilizumab. Bệnh nhân cần được kiểm soát theo các hướng dẫn lâm sàng địa phương về kiểm soát tăng lipid máu.
- Quá liều:
Hiện tại có rất ít dữ liệu của việc dùng Actemra quá liều. Một trường hợp quá liều do vô ý được báo cáo ở một bệnh nhân bị đa u tủy dùng liều đơn 40 mg/kg. Không có tác dụng ngoại ý nào của thuốc được ghi nhận. Không có tác dụng ngoại ý nặng nào của thuốc được ghi nhận ở các người tình nguyện khoẻ mạnh khi nhận liều đơn lên đến 28 mg/kg, mặc dù giảm bạch cầu trung tính giới hạn liều dùng được ghi nhận.
- Chống chỉ định:
+ Chống chỉ định đối với những bệnh nhân mẫn cảm với Tocilizumab hoặc bất kỳ thành phần nào của thuốc.
+ Nhiễm trùng nặng, tiến triển.
+ Sử dụng ở phụ nữ có thai và cho con bú.
Thai kỳ: Không có dữ liệu đầy đủ về việc dùng Actemra ở phụ nữ mang thai. Một nghiên cứu trên khỉ không cho thấy bất kỳ tiềm năng gây quái thai nào nhưng có số trường hợpsẩy thai tự nhiên/chết hoặc đe dọa phôi thai ở liều cao. Sự liên quan của những dữ liệu này ở người không rõ.
Không nên dùng Actemra trong thai kỳ trừ khi có chỉ định với nhu cầu y khoa rõ ràng.
Phụ nữ cho con bú: Chưa rõ liệu Actemra có bài tiết qua sữa mẹ hay không. Mặc dù globulin miễn dịch nội sinh của kháng nguyên IgG được tiết ra vào sữa mẹ, sự hấp thu toàn thân của Actemra thông qua việc cho bú sữa khó có thể xảy ra do sự thoái hoá nhờ thủy phân nhanh những loại protein này ở hệ thống tiêu hóa. Nên quyết định liệu có nên tiếp tục/ngừng cho bú hoặc tiếp tục/ngừng điều trị với Actemra, xét đến lợi ích của việc cho con bú và lợi ích của người phụ nữ khi điều trị với Actemra.
- Tương tác:
Các phân tích dược động học dân số không nhận thấy ảnh hưởng của MTX, các thuốc chống viêm không steroid hoặc corticosteroid tới sự thanh thải tocilizumab.
Điều trị đồng thời một liều duy nhất 10 mg/kg tocilizumab với 10-25 mg MTX một lần mỗi tuần không có tác động lâm sàng đáng kể trên sự phơi nhiễm MTX.
Tocilizumab chưa được nghiên cứu trong điều trị kết hợp với các DMARD sinh học khác.
Sự biểu hiện của enzyme CYP450 ở gan bị ức chế bởi các cytokine như IL6, sẽ kích hoạt quá trình viêm mạn tính. Do đó, sự biểu hiện của enzyme CYP450 có thể đảo ngược khi điều trị bằng các thuốc ức chế cytokine mạnh, như tocilizumab.
Các nghiên cứu in vitro trên tế bào gan người nuôi cấy chỉ ra rằng IL-6 làm giảm sự hình thành các enzyme CYP1A2, CYP2C9, CYP2C19, và CYP3A4. Tocilizumab bình thường hoá biểu hiện của các enzyme này.
Ảnh hưởng của tocilizumab tới các enzyme CYP (ngoại trừ CYP2C19 và CYP2D6) có liên quan về mặt lâm sàng với các chất nền CYP450 với chỉ số điều trị hẹp, và/hoặc khi điều chỉnh liều theo từng bệnh nhân.
Trong một nghiên cứu trên bệnh nhân viêm khớp dạng thấp, nồng độ simvastatin (CYP3A4) đã giảm 57% trong 1 tuần sau một liều duy nhất tocilizumab 1 tuần, tới mức tương tự hoặc cao hơn một chút so với nồng độ quan sát được ở người khoẻ mạnh.
Khi bắt đầu hoặc ngừng điều trị với tocilizumab, bệnh nhân dùng các thuốc đang được chỉnh liều theo cá thể và được chuyển hóa qua CYP450, CYP3A4, CYP1A2 hoặc CYP2C9 (ví dụ như atorvastatin, chẹn kênh canxi, theophyllin, warfarin, phenytoin, cyclosporin, hoặc benzodiazepines) cần được theo dõi vì liều các thuốc này có thể cần phải được điều chỉnh để duy trì hiệu quả điều trị. Do thời gian bán thải (t1⁄2) dài, hiệu quả của tocilizumab trên hoạt động của enzyme CYP450 có thể kéo dài vài tuần sau khi ngừng điều trị.
- Các tác dụng không mong muốn có thể gặp:
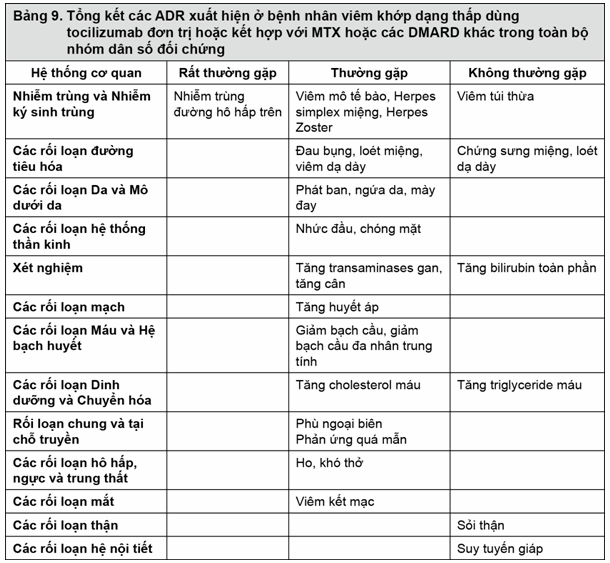
+ Nhiễm trùng: Trong các thử nghiệm có đối chứng kéo dài 6 tháng, tỉ lệ của tất cả các trường hợp nhiễm trùng được báo cáo ở nhóm điều trị Actemra 8 mg/kg phối hợp với DMARD là 127 biến cố/100 bệnh nhân/năm so với 112 biến cố/100 bệnh nhân/năm ở nhóm giả dược + DMARD. Trong toàn bộ dân số phơi nhiễm tỉ lệ chung của các trường hợp nhiễm trùng ở nhóm Actemra + DMARD là 108 biến cố/100 bệnh nhân/năm.
Trong toàn bộ dân số phơi nhiễm tỉ lệ chung của nhiễm trùng nặng là 4,7/100 bệnh nhân/năm.
Nhiễm trùng nặng, một số gây tử vong, được báo cáo bao gồm viêm phổi, viêm mô tế bào, Herpes Zoster, viêm dạ dày ruột, viêm túi thừa, nhiễm trùng huyết, viêm khớp nhiễm trùng. Các trường hợp nhiễm trùng cơ hội đã được báo cáo.
Bệnh phổi kẽ: Suy giảm chức năng phổi có thể làm tăng nguy cơ mắc nhiễm trùng. Đã có những báo cáo về bệnh phổi kẽ (bao gồm viêm thành phế nang và xơ hóa phổi), một số trường hợp dẫn đến tử vong.
+ Thủng đường tiêu hoá: Trong các thử nghiệm lâm sàng có đối chứng trong 6 tháng, tỷ lệ chung của thủng đường tiêu hóa là 0,26/100 bệnh nhân/năm với liệu pháp tocilizumab. Trong dân số phơi nhiễm tỷ lệ chung của thủng đường tiêu hóa là 0,28/100 bệnh nhân/năm. Báo cáo về thủng đường tiêu hóa trên tocilizumab chủ yếu được báo cáo là biến chứng của viêm túi thừa bao gồm viêm phúc mạc mủ toàn thể hóa, thủng đường tiêu hóa dưới, rò và áp xe.
+ Các phản ứng do tiêm truyền: Trong các thử nghiệm lâm sàng có đối chứng trong 6 tháng, các tác dụng ngoại ý liên quan với truyền thuốc (các biến cố chọn lọc xuất hiện trong khi truyền hoặc trong vòng 24 giờ kể từ khi truyền thuốc) được báo cáo ở nhóm điều trị Tocilizumab 8 mg/kg + DMARD là 6,9% và ở nhóm điều trị giả dược + DMARD là 5,1%. Các biến cố ghi nhận trong quá trình truyền thuốc sơ bộ là những cơn tăng huyết áp và các biến cố ghi nhận trong vòng 24 giờ từ khi kết thúc truyền thuốc là nhức đầu và phản ứng ở da (phát ban, mề đay). Những biến cố này không hạn chế việc điều trị.
+ Tỷ lệ sốc phản vệ (xảy ra ở tổng số 6/3778 bệnh nhân) cao hơn nhiều lần ở nhóm dùng liều 4 mg/kg so với nhóm dùng liều 8 mg/kg. Các phản ứng quá mẫn có ý nghĩa lâm sàng đáng kể liên quan điều trị Actemra khiến phải ngừng điều trị, đã được ghi nhận 13 trên tổng số 3778 bệnh nhân (0,3%) điều trị với Tocilizumab trong các thử nghiệm lâm sàng nhãn mở và có nhóm chứng. Những phản ứng này nhìn chung được ghi nhận trong quá trình truyền Tocilizumab ở lần thứ 2 đến thứ 5.
+ Tính sinh miễn dịch: Tổng cộng có 2.876 bệnh nhân đã được xét nghiệm kháng thể kháng tocilizumab trong các thử nghiệm lâm sàng có đối chứng trong 6 tháng. Bốn mươi sáu bệnh nhân (1,6%) đã có kháng thể kháng tocilizumab dương tính trong đó 5 người có liên quan đến phản ứng quá mẫn đáng kể về mặt y khoa phải ngưng thuốc. Ba mươi bệnh nhân (1,1%) đã hình thành kháng thể trung hòa.
+ Viêm khớp dạng thấp giai đoạn sớm: Nghiên cứu VI (WA19926) đánh giá 1162 bệnh nhân viêm khớp dạng thấp giai đoạn sớm, mức độ trung bình đến nặng và chưa điều trị với MTX và thuốc sinh học. Tính an toàn được quan sát thấy ở nhóm dùng tocilizumab tương tự với tính an toàn đã được biết đến của tocilizumab.
- Đơn trị: tocilizumab so với adalimumab:
Trong một nghiên cứu mù đôi, song song 24 tuần (đơn trị với tocilizumab truyền tĩnh mạch 8mg/kg mỗi 4 tuần (N=162) so sánh với adalimumab tiêm dưới da 40mg mỗi 2 tuần (N=162)), tác dụng không mong muốn tổng thể của tocilizumab và adalimumab tương tự nhau. Tỷ lệ bệnh nhân bị tác dụng không mong muốn nghiêm trọng giữa 2 nhóm điều trị là tương đương nhau, với tác dụng không mong muốn thường gặp nhất là nhiễm khuẩn (3,1% ở mỗi nhóm). Các chỉ số xét nghiệm đánh giá tính an toàn (như giảm bạch cầu trung tính và giảm tiểu cầu, tăng men gan ALT, AST và tăng lipid) cũng thay đổi tương tự nhau ở 2 nhóm điều trị, tuy nhiên, mức độ thay đổi và tần suất các bất thường đáng chú ý xảy ra ở nhóm tocilizumab cao hơn nhóm adalimumab.
+ Nhiễm trùng: Tỉ lệ các trường hợp nhiễm trùng ở nhóm điều trị Tocilizumab là 163,7 biến cố/100 bệnh nhân/năm. Biến cố quan sát được phổ biến nhất là viêm mũi họng và nhiễm trùng đường hô hấp trên. Tỷ lệ nhiễm trùng nặng cao hơn đáng kể ở những bệnh nhân có trọng lượng < 30kg, điều trị bằng liều 10 mg/kg tocilizumab (12,2/100 bệnh nhân/năm) so với số bệnh nhân có trọng lượng ≥ 30kg, điều trị liều 8 mg/kg tocilizumab (4,0 biến cố/100 bệnh nhân/năm). Tỷ lệ nhiễm trùng dẫn đến ngừng thuốc cũng cao hơn đáng kể ở những bệnh nhân có trọng lượng < 30kg điều trị liều 10 mg/kg tocilizumab (21,4%) so với những bệnh nhân có trọng lượng ≥ 30kg, điều trị với liều 8 mg/kg tocilizumab (7,6%).
+ Phản ứng tiêm truyền: Đối với bệnh nhân pJIA, phản ứng có liên quan đến tiêm truyền được định nghĩa là tất cả các biến cố xảy ra trong hoặc trong vòng 24 giờ truyền. Trong nhóm dùng tocilizumab, 11 bệnh nhân (5,9%) đã từng xảy ra các biến cố trong quá trình truyền, và 38 bệnh nhân (20,2%) gặp một biến cố trong vòng 24 giờ truyền. Một số biến cố phổ biến nhất xuất hiện trong quá trình truyền là đau đầu, buồn nôn và tụt huyết áp và trong vòng 24 giờ truyền là chóng mặt và tụt huyết áp. Nhìn chung, các phản ứng bất lợi của thuốc quan sát được trong hoặc trong vòng 24 giờ truyền tương tự như đã quan sát được ở những bệnh nhân RA và sJIA.
+ Không có báo cáo về các phản ứng quá mẫn có ý nghĩa lâm sàng liên quan đến dùng tocilizumab và dẫn đến phải ngừng điều trị.
+ Tính sinh miễn dịch: 1 bệnh nhân trong nhóm 10 mg/kg < 30kg phát hiện dương tính với các kháng thể kháng tocilizumab nhưng không gây phản ứng dị ứng và sau đó phải rút khỏi nghiên cứu.
+ Phản ứng quá mẫn có ý nghĩa lâm sàng liên quan tocilizumab và dẫn đến ngừng điều trị, được ghi nhận ở 1 trong số 112 bệnh nhân (< 1%) được điều trị với tocilizumab trong thử nghiệm lâm sàng giai đoạn có đối chứng và mở nhãn.
Tính sinh miễn dịch: Tất cả 112 bệnh nhân đã được xét nghiệm kháng thể kháng tocilizumab tại thời điểm ban đầu. 2 bệnh nhân phát hiện dương tính với các kháng thể kháng tocilizumab trong đó có 1 bệnh nhân có phản ứng dị ứng tới phải ngừng dùng thuốc.
- Bảo quản:
Với ống tiêm: giữ ở 2-8oC, không giữ đông. Giữ lọ thuốc nguyên trong hộp để tránh ánh sáng.
Dung dịch truyền Tocilizumab sau khi pha ổn định về mặt vật lý và hóa học trong dung dịch muối sinh lý 0,9% khối lượng/thể tích ở 30oC trong 24 giờ.
Về phương diện vi sinh học, dung dịch truyền sau khi pha nên được dùng ngay lập tức. Nếu không dùng ngay, thời gian bảo quản và các điều kiện trước khi dùng phải được người sử dụng đặc biệt quan tâm và không quá 24 giờ ở 2-8oC, trừ khi thao tác pha thuốc được tiến hành ở những điều kiện vô trùng được công nhận và kiểm soát.
- Trình bày/Đóng gói:
Dung dịch cô đặc pha dung dịch truyền: ống 80mg/4ml, ống 200mg/10ml, ống 400mg/20ml.
Tài liệu tham khảo:
1. https://dinhnghia.com.vn/interleukin-6-la-gi-dac-diem-tac-dung-co-che-hoat-dong-cua-interleukin-6/
2. https://www.dieutri.vn/bghuyethoctruyenmau/dac-diem-va-chuc-nang-cua-cac-cytokin
3. https://www.microbiologybook.org/Vietnamese%20Immuno/vietnamese-immchapter13.htm
6. https://www.dieutri.vn/a/actemra
7. https://www.thuocbietduoc.com.vn/thuoc-43850/actemra.aspx