Hội chứng gan thận
HỘI CHỨNG GAN THẬN
1. Đại cương
Hội chứng gan - thận (Hepatorenal syndrome – HRS) là tình trạng suy thận chức năng xảy ra chủ yếu ở bệnh nhân xơ gan cổ trướng có suy gan rất nặng, ngoài ra có thể gặp ở suy gan cấp hoặc viêm gan rượu. Tình trạng suy giảm chức năng thận là hậu quả của sự rối loạn chức năng tuần hoàn và hoạt động quá mức của hệ thần kinh giao cảm và hệ renin-angiotensin. Mặc dù là tổn thương thận chức năng, HRS lại có tiên lượng rất tồi và điều trị hiệu quả duy nhất là ghép gan.
Tỷ lệ gặp lhoảng 20 % bệnh nhân suy gan có cổ chướng trong một năm đầu và tăng lên 40% trong năm năm sau.
Tỷ lệ tử vong 80 – 95%. Thời gian sống trung bình 2 tuần.
2. Phân loại
HRS có 2 týp.
+ HRS týp 1 đặc trưng bởi tình trạng suy thận tiến triển nhanh, nghĩa là tăng gấp đôi nồng độ creatinin huyết thanh ban đầu lên mức trên 226mcmol/L trong vòng 2 tuần. HRS týp 1 có thể xuất hiện tự phát, nhưng thường sau các yếu tố thúc đẩy, đặc biệt là nhiễm trùng dịch cổ trướng.
+ HRS týp 2 đặc trưng bởi tình trạng suy thận tiến triển ở mức độ trung bình, nồng độ creatinin huyết thanh từ 133 – 226mcmol/L, thường tiến triển tự phát nhưng cũng có thể xuất hiện sau các yếu tố thúc đẩy. HRS týp 2 điển hình thường kèm cổ trướng dai dẳng.
Tiên lượng của HRS týp 1 là rất nặng. Tiên lượng sống của bệnh nhân HRS týp 2 thường ngắn hơn bệnh nhân xơ gan không có suy thận nhưng tốt hơn HRS týp 1.
3. Nguyên nhân và cơ chế bệnh sinh
3.1. Cơ chế bệnh sinh
HRS là tình trạng suy thận chức năng, được chứng minh bởi các bằng chứng sau: (1) mô bệnh học nhu mô thận bình thường, (2) có thể lấy thận ở bệnh nhân HRS để ghép, sau ghép chức năng thận tiến triển bình thường và (3) HRS có thể đảo ngược sau khi ghép gan [2]. Tình trạng bất thường chức năng thận nói chung và HRS nói riêng ở bệnh nhân xơ gan là một quá trình diễn biến qua các giai đoạn sau:
Giai đoạn 1: giảm bài tiết natri niệu ở xơ gan còn bù.
Bất thường chức năng thận xuất hiện đầu tiên ở bệnh nhân xơ gan là giảm khả năng bài tiết natri, bất thường này xuất hiện trước khi tiến triển có dịch cổ trướng. Trong giai đoạn này, bệnh nhân có tưới máu thận, mức lọc cầu thận, cân bằng nước tự do bình thường và còn khả năng đào thải natri từ chế độ ăn. Tuy nhiên khả năng bài tiết natri đã giảm một cách kín đáo, nghĩa là giảm đáp ứng thải natri niệu khi có tăng đột ngột natri vào cơ thể (ví dụ sau truyền dung dịch có natri). Một biểu hiện khác là giảm khả năng thải natri niệu khi thay đổi tư thế: bài tiết natri niệu giảm khi đứng thẳng và tăng hơn khi nằm so với người bình thường. Ngoài ra, bệnh nhân xơ gan giai đoạn này còn có tình trạng tăng thể tích plasma, gợi ý tình trạng giữ natri. Những bất thường này xuất hiện ở bệnh nhân có tăng áp lực tĩnh mạch cửa và sức kháng tuần hoàn ngoại vi thấp, điều này cho thấy có sự liên quan với tình trạng suy giảm chức năng tuần hoàn. Cụm từ xơ gan tiền cổ trướng (preascitic cirrhosis) được dùng cho giai đoạn này của bệnh, mặc dù không có nghiên cứu nào chỉ ra tình trạng sắp hình thành dịch cổ trướng. Khả năng đào thải natri của thận ở bệnh nhân xơ gan còn bù đang ở mức giới hạn và những bệnh nhân này có thể hình thành cổ trướng khi có yếu tố thúc đẩy tăng lượng natri vào hoặc suy giảm đào thải natri niệu.
Giai đoạn 2: giữ natri không có hoạt hóa hệ rennin – angiotensin – aldosterone và hệ thần kinh giao cảm.
Cùng với sự tiến triển của bệnh, bệnh nhân không thể đào thải lượng natri nhập vào cơ thể hàng ngày. Natri bị giữ lại sẽ gây giữ nước ở mô kẽ và tích lũy dịch ở trong khoang bụng, hình thành cổ trướng. Bài tiết natri niệu mặc dù giảm, nhưng thường cao hơn mức 10mEq/ ngày, và ở một số bệnh nhân là khoảng 50 – 90mEq / ngày. Do nguyên nhân chính là mất cân bằng natri vào – ra nên điều trị dịch cổ trướng ở giai đoạn này có thể chỉ bằng hạn chế natri trong chế độ ăn. Trong giai đoạn này, tưới máu thận, mức lọc cầu thận, khả năng đào thải nước tự do, hoạt độ renin huyết thanh và nồng độ hormon kháng bài niệu huyết thanh vẫn ở mức bình thường và có sự tăng nồng độ các peptid natriuretic (ANP và BNP) và hormon natriuretic trong huyết thanh. Điều này cho thấy có tình trạng suy giảm chức năng tuần hoàn, mặc dù ở mức độ lớn hơn so với giai đoạn xơ gan còn bù không cổ trướng, nhưng vẫn chưa đủ đủ để kích thích hệ thần kinh giao cảm và hệ thống rennin- angiotensin- aldosterone.
Giai đoạn 3: kích thích hệ thống co mạch nội sinh nhưng sự tưới máu thận và mức lọc cầu thận vẫn được bảo tồn.
Khi tình trạng giữ muối nước nhiều hơn (mức đào thải natri niệu dưới 10mEq/ ngày), sẽ kích thích tăng hoạt động renin huyết thanh và tăng nồng độ aldosterone và norepinephrine huyết thanh. Aldosterone làm tăng hấp thu natri ở ống lượn xa và ống góp. Ngược lại hoạt động thần kinh giao cảm ở thận kích thích tái hấp thu natri ở ống lượn gần, quai Henle và ống lượn xa. Vì thế tình trạng giữ natri ở giai đoạn này do tăng tái hấp thu ở toàn bộ nephron.
Thể tích tuần hoàn, cung lượng tim và sức cản mạch máu ngoại vi ở những bệnh nhân này không thay đổi so với giai đoạn trước. Tuy nhiên, rối loạn chức năng tuần hoàn thì rõ hơn bởi vì có sự tăng hoạt động của hệ thần kinh giao cảm và hệ thống renin-angiotensin để cố gắng duy trì sự ổn định của hệ tuần hoàn. Huyết áp động mạch ở giai đoạn này phụ thuộc chủ yếu vào sự tăng hoạt động của renin-angiotensine, hệ thần kinh giao cảm và hormon kháng bài niệu. Việc sử dụng các thuốc ảnh hưởng đến hệ thống này (saralasin, losartan, thuốc ức chế men chuyển, clonidine và các thuốc đối kháng vasopressin VI) có thể dẫn đến hạ huyết áp và suy thận.
Mặc dù angiotensin II, norephinephrine và hormon kháng bài niệu có tác dụng co mạch thận mạnh, ở giai đoạn này, Tưới máu thận và mức lọc cầu thận vẫn bình thường hoặc chỉ giảm ở mức trung bình vì tác dụng của các chất này trên tuần hoàn thận bị đối kháng bởi hệ thống giãn mạch tại thận, đặc biệt là prostaglandin. Khi xơ gan, tình trạng tưới máu thận và mức lọc cầu thận phụ thuộc phần lớn vào khả năng thận sản xuất các prostaglandin, vì thế suy thận có thể xuất hiện ở giai đoạn này nếu như các prostaglandin ở thận bị ức chế bởi thuốc NSAIDs. Các hệ thống giãn mạch khác có thể giúp duy trì chức năng thận ở giai đoạn này là nitric oxide và các peptid natriuretic. Khả năng bài tiết nước tự do của thận ở giai đoạn này giảm, do nồng độ cao hormon kháng bài niệu trong huyết thanh. Tuy nhiên, chỉ có vài bệnh nhân có giảm nồng độ natri máu nặng do hiệu quả của hormon kháng bài niệu bị đối kháng bởi prostaglandin E2 do thận sản xuất.
Giai đoạn 4: sự xuất hiện của hội chứng gan thận týp 2
HRS týp 2 xuất hiện ở giai đoạn tiến triển của xơ gan, khi có sự suy giảm chức năng tuần hoàn nặng. Bệnh nhân HRS týp 2 có nồng độ renin, aldosterine, norepinephrine và hormon kháng bài niệu trong huyết thanh rất cao; huyết áp động mạch giảm đáng kể và nhịp tim tăng. Sức kháng động mạch tăng không chỉ ở thận mà còn ở các cơ quan khác như não, cơ và da, điều này chỉ ra có tình trạng co mạch hệ thống để bù lại sự giãn động mạch nội tạng. HRS týp 2 thường do hoạt động quá mức của hệ thống co mạch nội sinh, hoạt động này vượt quá cơ chế giãn mạch tại thận.
Mức độ giữ natri ở HRS týp 2 là rất lớn. Các bệnh nhân có biểu hiện giảm mức lọc natri và tăng tái hấp thu natri ở ống lượn gần. Sự vận chuyển natri tới ống lượn xa là rất thấp, mà ống lượn xa lại là vị trí tác dụng của thuốc lợi tiểu. Vì thế các bệnh nhân này không đáp ứng với thuốc lợi tiểu và biểu hiện tình trạng cổ trướng kháng trị. Mức lọc nước tự do giảm đáng kể và hầu hết bệnh nhân biểu hiện gỉảm nồng độ natri máu nặng. Tiến triển bệnh nhân có HRS týp 2 rất xấu, với tỷ lệ sống 5 tháng và 1 năm sau khi xuất hiện suy thận là 50% và 20%.
Giai đoạn 5: tiến triển hội chứng gan thận týp 1
Mặc dù hội chứng gan thận týp 1 có thể diễn biến tự phát, nhưng nó thường xuất hiện sau một yếu tố thúc đẩy, như tình trạng nhiễm trùng nặng, viêm gan cấp trên nền gan xơ (do hoại tử, do rượu, do độc chất hoặc do virus), bệnh nhân trải qua một phẫu thuật lớn hoặc xuất huyết tiêu hóa nặng. Bệnh nhân HRS týp 2 đặc biệt có nguy cơ xuất hiện HRS týp 1, mặc dù HRS týp 1 có thể xuất hiện ở bệnh nhân không có HRS týp 2 trước đó. Tiên lượng HRS týp 1 rất tồi: 80% tử vong trong vòng 1 tuần sau khi khởi phát HRS. Bệnh nhân tử vong trong tình trạng suy gan, thận, suy tuần hoàn tiến tiển và hội chứng não gan.
30% bệnh nhân nhiễm trùng dịch cổ trướng sẽ tiến triển HRS týp 1. Hai yếu tố dự báo sự xuất hiện HRS týp 1 ở bệnh nhân nhiễm trùng dịch cổ trướng là có tăng nồng độ creatinin huyết thanh trước khi nhiễm trùng và đáp ứng viêm mạnh trong ổ bụng (biểu hiện bằng số lượng bạch cầu đa nhân trung tính trong dịch cổ trướng cao và nồng độ các cytokine (yếu tố hoại tử u TNF-α và interleukin 6) tăng cao trong dịch cổ trướng) [3].
HRS týp 1 có thể tiến triển mặc dù tình trạng nhiễm trùng dịch cổ trướng đáp ứng nhanh với sử dụng thuốc kháng sinh vì HRS týp 1 xuất hiện khi có tình trạng suy giảm nặng chức năng tuần hoàn. Nghiên cứu đánh giá tình trạng huyết động và chức năng thận ở bệnh nhân nhiễm trùng dịch cổ trướng tại thời điểm chẩn đoán và 1 tuần sau thấy, mặc dù tình trạng nhiễm khuẩn được khống chế ở hầu hết các bệnh nhân, nhưng HRS tiến triển do liên quan đến tình trạng giảm đáng kể cung lượng tim. Cùng với tình trạng giãn động mạch nội tạng, giảm cung lượng tim dẫn đến giảm thể tích tuần hoàn động mạch hiệu dụng. Việc điều trị bù lại thể tích tuần hoàn bằng truyền albumin tại thời điểm chẩn đoán nhiễm trùng có thể làm giảm trên 60% tỷ lệ suy thận và tử vong trong bệnh viện ở bệnh nhân nhiễm trùng dịch cổ trướng.
Diễn biến tự nhiên của HRS týp 1 liên quan nhiều đến tình trạng suy giảm nhanh chóng chức năng tuần hoàn hệ thống cũng như là sự thay đổi trong cơ chế giãn mạch tại thận. Thận sản xuất ra các chất giãn mạch, như các prostaglandin và NO, các chất này làm giảm tác dụng của hệ thống co mạch nội sinh trên sự tưới máu thận và mức lọc cầu thận. Khi có giảm tưới máu thận, việc tổng hợp các chất giãn mạch có thể suy giảm. Tiến triển HRS týp 1 là có liên quan đến giảm sản xuất các chất đối kháng với sự hoạt động quá mức của hệ renin-angiotensine, hệ thần kinh giao cảm và hormon kháng bài niệu. Mặt khác việc hoại tử nhu mô thận do giảm tưới máu sẽ kích thích tổng hợp tại thận các chất co mạch như angiotensin II và adenosine. Có thể coi như HRS týp 1 được khởi đầu bằng sự suy giảm đột ngột chức năng tuần hoàn xảy ra trên bệnh nhân đã có giảm chức năng tuần hoàn trước đó nhưng còn bù, dẫn đến hoại tử thiếu máu thận, tăng sản xuất các chất co mạch tại thận, giảm tổng hợp các chất giãn mạch thận và hậu quả cuối cùng càng làm thiếu máu thận. Vòng xoắn bệnh lý này ngày càng làm suy giảm chức năng thận. Việc truyền kéo dài 1- 2 tuần albumin đường tĩnh mạch và các chất co mạch (ornipressin, noradrenaline) làm cải thiện chức năng tuần hoàn và làm giảm hoạt động renin huyết thanh, nồng độ norepinephrine xuống mức bình thường hoặc gần bình thường trong 2 -3 ngày đầu điều trị, tuy nhiên mức lọc cầu thận thì vẫn có thể không tăng được sau 1 – 2 tuần điều trị, điều này cho thấy vẫn còn một khoảng cách lớn giữa việc bình thường chức năng tuần hoàn hệ thống với cải thiện tưới máu thận và chức năng thận. Khi HRS đã được cải thiện sau khi bồi phục thể tích tuần hoàn bằng albumin và sử dụng các thuốc co mạch, HRS thường không tái xuất hiện sau khi dừng điều trị, điều này gợi ý tình trạng suy thận tiến triển nhanh là do hậu quả của các yếu tố thúc đẩy khác hơn là do bản thân tình trạng suy gan.
3.2. Nguyên nhân
- Các yếu tố thúc đẩy:
+ Nhiễm trùng dịch cổ trướng gây HRS týp 1 đến 20%.
+ Rút quá nhiều dịch cổ chướng mà không truyền bù plasma, thưòng gây HRS týp 1 đến 15%.
+ Phẫu thuật lớn.
+ Xuất huyết tiêu hóa.
+ Các thuốc độc với thận: giảm đau chống viêm, thuốc lợi tiểu quá liều.
- Các bệnh nhân có nguy cơ cao:
+ Suy gan nặng.
+ Có cổ chướng trước đó.
+ Gan không to.
+ Suy dinh dưỡng.
+ Có suy thận nhẹ trước đó(Cr >1.5mg/dl, MLCT <50ml/p).
+ Natri máu thấp.
+ Tăng Kali máu.
+ Giảm áp lực keo máu.
+ Tăng áp lức thẩm thấu niệu.
+ Giãn TM thực quản.
4. Triệu chứng
4.1. Lâm sàng
- Tình trạng suy gan tiến triển: vàng da, rối loạn đông máu, suy dinh dưỡng, hôn mê gan.
- Thiểu niệu, vô niệu. Nước tiểu < 500ml/24h không cải thiện khi dùng lợi tiểu hoặc bù albumim.
- Không có biểu hiện của các bệnh gây suy thận chức năng và thực thể.
- Tình trạng suy tuần hoàn: huyết áp động mạch giảm.
4.2. Cận lâm sàng
- Xét nghiệm sinh hóa: biểu hiện suy chức năng gan.
- Creatin máu tăng, điện giải đồ máu, điện giải đồ niệu:biểu hiện suy thận cấp trước thận (giảm nồng độ Na niệu, tăng áp lực thẩm thấu niệu và tăng tỷ lệ áp lực thẩm thấu niệu/ áp lực thẩm thấu máu).
- Các xét nghiệm loại trừ nguyên nhân gây suy thận khác.
- Siêu âm bụng: kích thước thận bình thường, nhu mô và đài bể thận bình thường.
5. Chẩn đoán
5.1. Chẩn đoán xác định
Tiêu chuẩn chẩn đoán mới năm 2007 có nhiều điểm khác biệt so với tiêu chuẩn cũ năm 1997. Độ thanh thải creatinin đã được bỏ ra khỏi tiêu chuẩn chẩn đoán vì cách tính phức tạp, mặt khác nó cũng không làm tăng thêm độ chính xác trong việc dự báo tình trạng suy giảm chức năng thận ở bệnh nhân xơ gan. Tình trạng suy thận khi nhiễm trùng tiến triển không có shock nhiễm khuẩn hiện nay đã được coi như là HRS. Điều này có ý nghĩa là việc điều trị HRS có thể bắt đầu ngay mà không phải chờ đến khi kiểm soát hoàn toàn tình trạng nhiễm trùng. Việc bồi phụ thể tích tuần hoàn phải được thực hiện bằng truyền albumin chứ không phải là bằng dung dịch muối đẳng trương. Và cuối cùng, các tiêu chuẩn phụ trong tiêu chuẩn chẩn đoán 1997 đã được bỏ vì chúng không cần thiết [1].
5.2. Chẩn đoán phân biệt
Do không có xét nghiệm đặc hiệu chẩn đoán HRS và bệnh nhân xơ gan tiến triển có thể suy thận do các nguyên nhân khác (suy thận trước thận do giảm thể tích tuần hoàn, hoại tử ống thận cấp, tổn thương thận do thuốc hoặc viêm cầu thận), để chẩn đoán HRS là phải loại trừ được suy thận thứ phát do giảm thể tích tuần hoàn và bệnh lý tại thận.
- Suy thận do bệnh lý tại thận:
Bệnh nhân xơ gan cũng có thể kèm theo bệnh lý tại thận gây suy thận. Trong trường hợp này, xét nghiệm nước tiểu sẽ có protein niệu, hồng cầu niệu, trụ niệu. Siêu âm thận sẽ thấy các biểu hiện của suy thận mạn như kích thước thận teo nhỏ, nhu mô tăng âm, mất ranh giới tủy vỏ.
- Suy thận cấp trước thận:
Tình trạng suy thận cấp do mất dịch qua đường tiêu hóa (nôn hoặc ỉa chảy), mất dịch qua đường tiết niệu do dùng lợi tiểu quá mức phải được lưu ý. Nếu suy thận thứ phát do giảm thể tích tuần hoàn, chức năng thận sẽ cải thiện nhanh chóng sau khi bù đủ thể tích tuần hoàn và giải quyết được yếu tố thúc đẩy tình trạng giảm thể tích tuần hoàn.
Sốc là tình trạng thường gặp ở bệnh nhân xơ gan và có thể gây suy thận cấp trước thận, nếu không điều trị tích cực thì có thể dẫn đến hoại tử ống thận cấp. Mặc dù giảm thể tích tuần hoàn do xuất huyết tiêu hóa thường dễ nhận ra, sốc nhiễm khuẩn có thể khó phát hiện vì triệu chứng nhiễm trùng ở một số bệnh nhân xơ gan lại rất mờ nhạt. Hơn nữa tình trạng giảm huyết áp động mạch lại có thể nhầm là do bệnh gan tiến triển. Một số bệnh nhân, vô niệu (do sốc nhiễm khuẩn) lại là triệu chứng đầu tiên của tình trạng nhiễm trùng, vì thế có thể bị chẩn đoán nhầm HRS. Tình trạng suy thận ở những bệnh nhân này có thể cải thiện sau khi dùng kháng sinh hoặc có thể tiến triển thành HRS thực sự, kể cả khi nhiễm trùng được khống chế.
- Hoại tử ống thận cấp:
Ngoài tình trạng sốc kéo dài không phục hồi dẫn đến hoại tử ống thận cấp, bệnh nhân xơ gan có nguy cơ tiến triển suy thận nặng do dùng các thuốc như các thuốc giảm đau chống viêm không steroid, thuốc kháng sinh nhóm aminoglycosides.
6. Điều trị
6.1. Dự phòng hội chứng gan thận
- Dùng kháng sinh và truyền albumin ở bệnh nhân xơ gan nhiễm trùng dịch cổ trướng có thể dự phòng HRS.
- Bồi phụ thể tích tuần hoàn trong các trường hợp mất dịch như ỉa chảy, xuất huyết tiêu hóa.
- Tránh sử dụng lợi tiểu quá mức gây mất dịch.
- Không sử dụng các thuốc độc với thận như NSAIDs, kháng sinh nhóm aminoglycosides.
6.2. Điều trị hội chứng gan thận týp 1
Các thuốc co mạch và albumin được khuyến cáo như là điều trị bước đầu cho HRS týp 1. Terlipressin là thuốc co mạch được sử dụng rộng rãi nhất. Midodrine cùng octreotide và Dopamin là hai điều trị khác cần thêm các đánh giá lâm sàng. Dopamin có thể dùng liều thấp 1.5 – 2mcg/kg cân nặng/giờ kết hợp với truyền albumin.
Sử dụng terlipressin (0,5 – 2mg mỗi 4 giờ tiêm tĩnh mạch chậm) và albumin (1g/ ngày trong ngày đầu và sau đó 20 – 40g/ ngày) có thể giúp hồi phục tình trạng suy thận trong 60% các trường hợp, tuy nhiên cải thiện tình trạng sống thì còn rất hạn chế. Terlipressin khởi liều 0.5mg cứ 4 giờ. Nếu sau 3 ngày, nồng độ creatinin huyết thanh không giảm, tăng dần liều mỗi 3 ngày lên 1mg, hoặc 1,5mg, hoặc 2mg cứ mỗi 4 giờ cho tới khi nồng độ creatinin huyết thanh giảm. Mục đích điều trị là giảm nồng độ creatinin huyết thanh < 133mmol/L. Điều trị có thể dừng nếu nồng độ creatinin huyết thanh không giảm ít nhất 50% sau 7 ngày sử dụng liều cao terlipressin hoặc không giảm sau 3 ngày đầu điều trị. Ở bệnh nhân có đáp ứng, điều trị kéo dài cho đến khi HRS được đảo ngược hoặc tối đa 14 ngày. Terlipressin có thể gây ra các tác dụng phụ co mạch gây thiếu máu và rối loạn nhịp tim, khi đó buộc phải dừng điều trị.
TIPS (Transjugular Intrahepatic Portosystemic Shunt: Tạo đường thông cửa - chủ trong gan qua đường tĩnh mạch cảnh trong) là biện pháp được lựa chọn cho một số bệnh nhân không đáp ứng với điều trị bằng các thuốc co mạch.
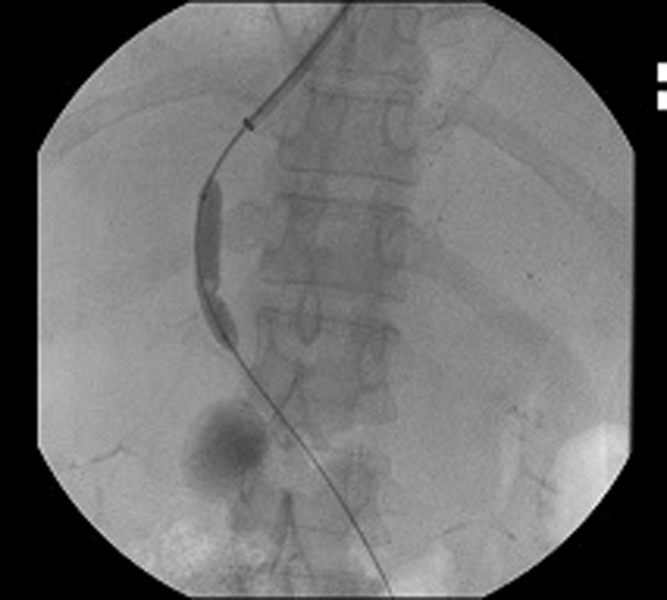
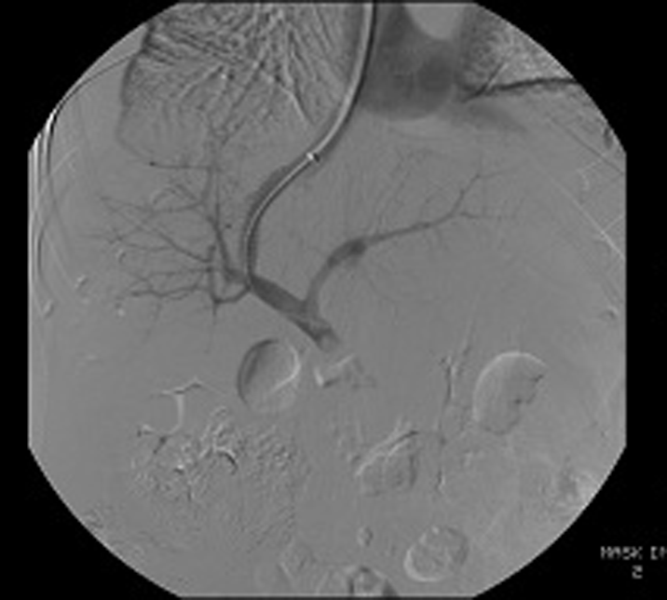
Hình 1: Thủ thuật TIPS (guide wire được luồn từ tĩnh mạch cảnh trong qua tĩnh mạch chủ dưới vào tĩnh mạch trên gan, chọc qua nhu mô gan vào tĩnh mạch cửa, bóng được đặt vào vị trí nối giữa tĩnh mạch trên gan và tĩnh mạch cửa rồi bơm lên để nong rộng lỗ thông ở hình trái, sau đó stent được đặt vào lỗ thông, đầu trên của stent nằm trong tĩnh mạch trên gan, đầu dưới của stent nằm trong tĩnh mạch cửa tạo thành đường thông nối tĩnh mạch cửa và tĩnh mạch chủ qua tĩnh mạch trên gan ở hình phải).
Điều trị bằng tế bào gốc: bơm trực tiếp tế bào gốc vào động mạch gan, các tế bào gốc này phát triển biệt hóa thành tế bào gan đã giúp cải thiện chức năng gan. Đây là phương pháp mới được áp dụng ở một số nước và đang được tiếp tục nghiên cứu.
Ghép gan là điều trị duy nhất mang lại khả năng sống lâu dài.
6.3. Điều trị hội chứng gan thận týp 2
Ghép gan.
Chỉ dùng thuốc lợi tiểu điều trị cổ trướng khi natri niệu > 30mEq/l. Hạn chế muối.
Kết hợp chọc tháo dịch cổ trướng và truyền albumin khi có cổ trướng căng/lớn.
Hạn chế dịch trong trường hợp hạ natri máu.
Có thể sử dụng thuốc co mạch hoặc TIPS trong khi chờ ghép gan.
Hiện nay chưa có đủ dữ liệu về sử dụng thuốc co mạch ở bệnh nhân HRS typ 2. TIPS có thể làm cải thiện tình trạng cổ trướng dai dẳng (thường liên quan đến HRS typ 2), tuy nhiên dữ liệu vẫn chưa đầy đủ.
Điều trị bằng tế bào gốc: bơm trực tiếp tế bào gốc vào động mạch gan, các tế bào gốc này phát triển biệt hóa thành tế bào gan đã giúp cải thiện chức năng gan. Đây là phương pháp mới được áp dụng ở một số nước và đang được tiếp tục nghiên cứu.
TÀI LIỆU THAM KHẢO
- Francesco Salerno, Alexander Gerbes, Pere Ginès, Florence Wong, Vicente Arroyo. Diagnosis, prevention and treatment of hepatorenl syndrome in cirrhosis. Gut 2007;56:1310-1318
- Henryk Dancygier et al. Hepatorenal syndrome. Clinical hepatology – Principles and practice of hepatobiliary diseases. Springer 2010: 999-1005.
- Vicente Arroyo, Pere Ginès, Mónica Guevara and Juan Rodés. Renal dysfunction in cirrhosis: pathophysiology, clinical features and therapy. Zakim and Boyer’s Hepatology – A textbook of liver disease. Saunders Elsevier 2006: 415-452
- Sort P, Navasa M, Arroyo V, et al. Effect of intravenous albumin on renal impairment and mortality in patients with cirrhosis and spontaneous bacterialperitonitis. N Engl J Med 1999;5:403–9.
Nguồn: December 27, 2014. Bs. Nguyễn Hoài Nam. Khoa Tiêu hóa BV Bạch Mai