Bản đồng thuận đầu tiên về xử lý, điều trị viêm gan virus B của Việt nam (2013) (12/09/2013)
Bản đồng thuận được xây dựng bởi các chuyên gia đầu ngành về gan mật của Việt nam (Hội gan mật Việt nam). Bản đồng thuận khác với một phác đồ điều trị ở chỗ là cung cấp một phương pháp tiếp cận để xử lý tối ưu, trong đó có không gian để các bác sĩ có thể vận dụng kinh nghiệm của mình cùng các bằng chứng khoa học mới và thực tiễn đặng dẫn đến một quyết định cụ thể và chịu trách nhiệm về quyết định của mình.
Đồng thuận về điều trị viêm gan virus B của Việt nam
Danh sách các chuyên gia xây dựng bản đồng thuận về xử lý viêm gan virus B:
Gs Bs Phạm Hoàng Phiệt, Ts Bs Đinh quý Lan, GsTsBs Mai Hồng Bàng, Ths Bs Huỳnh Thanh Bình, Bs CK Nguyễn Hữu Chí, PGs Ts Bs Trần Xuân Chương, PGsTs Bs Bùi Hữu Hoàng, Ts Bs Phạm thị Lệ Hoa, PGS.TS Trần văn Hợp, GS. TS Vũ Bằng Đình. PGs Ts Bs Trần văn Huy, PGsTs Bs Trịnh thị Ngọc, Ts Bs Phạm thị Thu Thủy, PGs Ts Bs Nguyễn Hoàng Tiến, Ts Bs Hoàng Tiến Tuyên.
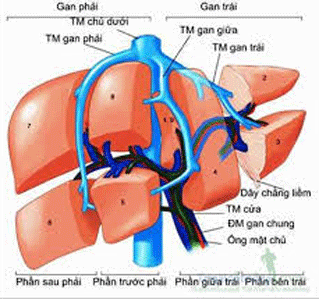
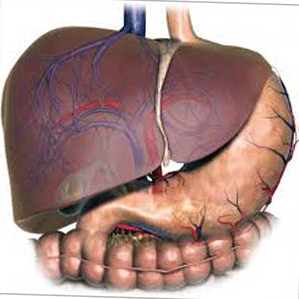
Hình 1. Phân chia phân thùy gan
1. Mở đầu
Viêm gan virus B (VGV B) là một gánh nặng y tế cho toàn thế giới cả về số lượng người bị nhiễm và tử vong cũng như tốn kém về kinh tế cho việc chăm sóc điều trị [1,2]. Việt nam là một trong vài nước có tỷ lệ bị nhiễm HBV cao vào bậc nhất của thế giới [3,4,5]. Tuy nhiên cho đến nay chúng ta vẫn chưa có một đồng thuận trong xử lý và điều trị VGV B cho các Bs lâm sàng và các nhân viên y tế có chức năng chăm sóc nhóm bệnh nhân quan trọng này. Bởi vậy việc soạn thảo bản đồng thuật này là một yêu cầu của cấp thiết của thực tiễn. Bản đồng thuận này không phải là một phác đồ điều trị mà chủ yếu nhằm cung cấp các bằng chứng khoa học dẫn đến những khuyến cáo xử lý VGV B một cách tối ưu mà các bác sĩ có thể vận dụng tùy hoàn cảnh cụ thể nhưng không bắt buộc phải theo một cách máy móc. Tuy đã có các bản đống thuận của nhiều hội gan mật lớn trên thế giới như APASL, AASLD, EASL nhưng chúng ta có những đặc điểm nhất định tuy không lớn nhưng có thể làm thay đổi cách xử lý cho thích hợp với hoàn cảnh thực tế.
2. Các thuật ngữ sử dụng và định nghĩa
2.1. Men ALT
Bình thường cao: Giá trị ALT huyết thanh trong giới hạn 0,5 dến 1 của GHTBT
Bình thường thấp: ALT huyết thanh <0,5 GHTBT
Tăng tối thiểu: ALT huyết thanh giữa GHTBT và 2GHTBT
2.2. Đáp ứng sinh hóa: Bình thường hóa mức ALT huyết thanh
2.3. Nhiễm HBV mạn tính: HBsAg dương tính kéo dài >6 tháng
2.4. Nhiễm HBV mạn không hoạt động: HBsAg+ và anti HBeAg+, ALT bình thường liên tục và mức HBVDNA <2x103 IU/ml ( <104 cp/ml)
2.5. Kháng thuốc
- Kháng kiểu gen: Phát hiện có đột biến kiểu kháng thuốc đã biết trên bộ gen HBV
- Kháng kiểu hiện: Giảm nhạy cảm in vitro với ức chế của thuốc kèm đột biến gen
- Kháng chéo: Đột biến kháng thuốc đặc hiệu với 1 loại thuốc dẫn đến giảm nhạy cảm với một loại thuốc khác
2.6. Gan mất bù: Rối loạn chức năng gan rõ rệt như tăng bilirubin, kéo dài thời gian máu đông, giảm albumin hay xuất hiện cổ chướng
2.7. Bùng phát viêm gan: Đột ngột tăng ALT lên >5 GHTBT
2.8. Không phát hiện HBVDNA: HBVDNA dưới ngưỡng phát hiện bởi kỹ thuật PCR
2.9. Đáp ứng virus
- Đáp ứng virus duy trì: Không phát hiện HBVDNA và chuyển đổi huyết thanh HBeAg (ở nhóm bn có HBeAg dương tính) khi vẫn còn dung thuốc
- Thất bại điều tri tiên phát: HBVDNA chỉ giảm <1log10 khi đã uống thuốc kháng virus 12 tuần trên bệnh nhân tuân thủ điều trị
- Đáp ứng virus cận ưu: HBVDNA còn phát hiện được sau 24 tuần uống thuốc ở bệnh nhân tuân thủ điều trị
- Thất bại điều trị thứ phát: Bùng phát virus mặc dù tuân thủ điều tri và đã có đáp ứng trước đó
- Đáp ứng bền vững: Không xuất hiện tái phát sau khi đã ngưng thuốc đặc trị 24 tuần
- Đáp ứng virus hoàn toàn: Mất HBsAg do được điều trị
2.10. Bùng phát virus: Mặc dù đang được điều trị mà HBVDNA tăng >1log10 và được xác nhận lại sau đó trong vòng 4 tuần
2.11. Tái phát virus: HBVDNA tăng >2x103 IU/ml (>104cp /ml) sau khi đã có đáp ứng virus và ngưng điều trị
2.12. Tái phát lâm sàng: HBVDNA tăng >2x103 IU/ml (>104cp /ml) và tăng ALT >2 GHTBT sau khi đã có đáp ứng virus và ngưng điều trị
Chú thích chữ viết tắt:
GHTBT = Giới hạn trên của bình thường
Cp/cps =bản sao virus (copy/copies)
3. Diễn biến tự nhiên của nhiễm HBV
Vùng châu Á thái bình dương có tỷ lệ và số người nhiễm HBV cao nhất của thế giới. Hơn nữa trong vùng này hầu hết các nước thuộc về thế giới đang phát triển với kinh tế còn hạn chế làm cho vấn đề chăm lo sức khỏe nói chung và bệnh nhân nhiễm HBV nói riêng có khó khăn mà Việt nam cũng không là ngoại lệ. Ở Việt nam, lây truyền HBV từ mẹ sang con và giữa các trẻ nhỏ là một nguồn lây quan trọng nên tỷ lệ trở thành mạn tính cao đồng thời bệnh có một thời gian tiến triển lâu dài trong người bệnh đủ để gây ra các biến chứng muộn và nguy hiểm như xơ gan, suy gan và HCC. Một khi đã bị nhiễm HBV, do vòng đời của virus này có giai đoạn ở dạng cccDNA trong nhân tế bào giúp cho HBV tồn tại trong cơ thể hầu như suốt đời. Sự tồn tại HBV trong cơ thể ở các dạng lâm sàng khác nhau là do cân bằng động về mối tương tác giữa virus, tế bào gan và hệ thống miễm dịch của cơ thể. Nhiễm HBV từ tuổi trẻ thơ, diễn tiến tự nhiên lần lượt sẽ trải qua 3 pha là:
- Pha dung nạp miễn dịch
- Pha thải loại miễn dịch và
- Pha mang HBV không hoạt động.
3.1. Đặc điểm của pha dung nạp miễn dịch (pha 1):
Pha 1 là hệ thống miễn dịch của bệnh nhân không xem HBV như kẻ lạ xâm nhập nên virus tăng sinh không bị kiềm chế. Trong pha này số lượng virus thường rất cao >2x106 IU/ml (>107 cps/ml), có HBeAg dương tính (chỉ dấu huyết thanh của virus tăng sinh) nhưng ALT liên tục bình thường, gan không có hoặc chỉ có tổn thương tối thiểu nhưng tính lây nhiễm rất cao. Chuyển huyết thanh HBeAg tự nhiên trong pha này rất thấp gần như không xẩy ra.
Khảo sát ở Việt nam, pha này thường kéo dài khoảng 20 đến 25 năm [6] và không có chỉ định điều trị. Nhiễm HBV ở tuổi vị thành niên hay người lớn có thể không có pha này hoặc pha này chỉ xẩy ra trong một thời gian ngắn.
3.2. Đặc điểm của pha thải loại miễn dịch (pha 2)
Pha 2 là lúc này hệ thống miễn dịch của bệnh nhân bắt đầu chống lại HBV mà biểu hiện tên lâm sàng bằng giảm lượng HBV-DNA (so với pha 1) nhưng hầu hết vẫn ở mức >105 cps/ml, HBeAg vẫn dương tính, ALT tăng cao hoặc đôi khi có thể giao động, mô gan có tổn thương viêm và hoại tử và quá trình xơ hóa bắt đầu. Pha này kết thúc bằng việc chuyển đối huyết thanh HBeAg với xuất hiện đột biến PC (tiền lõi) hay/và BCP.
Pha thải loại miễn dịch càng dài và cường độ càng cao thì tốn thương viêm hoại tử và quá trình xơ hóa gan càng nhanh và để lại nhiều hậu quả dù có chuyển sang pha mang HBV không hoạt động. Chính vì vậy mà trong pha thải loại miễn dịch nếu kéo dài thì có chỉ định điều trị đặc hiệu. Chuyển huyết thanh HBeAg tự nhiên trong pha này tương đối cao vào khoảng 10% năm.
3.3. Pha mang HBV không hoạt động (pha 3)
Pha 3 có đặc điểm là HBeAg âm tính và xuất hiện anti HBe; lượng HBV-DNA thấp từ mức không phát hiện đến <104 cps/ml. Về bệnh sinh, lúc này hệ thống miễn dịch đã kiểm soát được HBV. Tổn thương gan để lại do pha thải loại miễn dịch nhiều hay ít nhưng không hoặc hầu như không có tổn thương đang tiến triển thêm. Vì vậy khi chuyển sang pha mang HBV không hoạt động mà gan còn ít bị tổn thương thì tiền lượng lâu dài là tương đối tốt, biến chứng thấp. Không có chỉ định điều trị đặc hiệu trong pha này.
Từ pha 3 này, bệnh cảnh lâm sàng có thể xuất hiện theo 2 hướng hoặc thuận lợi là mất HBsAg với tỷ lệ thấp từ 0,5% đến 2% mỗi năm hoặc theo hướng xấu đi tức là virus tái hoạt dưới thể viêm gan B có HBeAg âm tính hoăc quay trở về thê viêm gan B có HBeAg dương tính. Trong tình trạng tái hoạt động này có chỉ định đặc trị HBV.
Chính vì các diễn biến này mà một số tác giả xem diễn tiến tự nhiên của VGV B có 4 hay 5 pha mà không nhất thiết tiếp diễn nhau.
Xuất hiện xơ gan và HCC trong quá trình diễn tiến tự nhiên của bệnh nhân nhiễm HBV. Tỷ lệ biến chứng xơ gan xẩy ra trên bệnh nhân nhiểm mạn tính khoảng 2% năm và và HCC vào khoảng 0,5% năm. Tỷ lệ này tăng lên trên bệnh nhân có tuổi cao, nam giới, HBeAg dương tính, hay chuyển đổi huyết thanh HBeAg xẩy ra muộn sau 40 tuổi, ALT cao và đặc biệt là khi có tải lương HBV-DNA >104 cps/ml. Với HCC thì một khi đã có xơ gan tỷ lệ biến chứng thành HCC tăng cao gấp 10 lần ( 3% đến 6% năm) so với bệnh nhân chưa có xơ gan. Cần lưu ý là ở bệnh nhân VGV B, HCC có thể xẩy ra trên bệnh nhân chưa có xơ gan với tỷ lệ đáng kể, khoảng 30%. Do đó, theo dõi phát hiện sơm HCC phải thực hiện trên cả bệnh nhân chưa có xơ gan.
4. Một số khái niệm cơ bản
4.1. Typ gen HBV
Dựa vào trình tự bô gen của HBV khác biệt nhau >8% người ta chia HBV thành các typ gen. Hiện nay đã xác định được 10 typ gen của HBV là A,B,C,D,E,F,G,H,I và J.
Ở Việt nam chỉ có 2 typ gen chính là B và C (với dưới typ chính là B4 và C1)[7,8]. Về tính gây bệnh, HBV typ C nguy hiểm hơn typ B mà trên lâm sàng biểu hiện là: typ gen C có biến chứng xơ gan, HCC cao hơn có ý nghĩa, chuyển đổi huyết thanh HBeAg chậm hơn khoảng 10 năm tỷ lệ đột biến kép BCP cao hơn và đáp ứng điều trị với IFN/P.IFN kém hơn [9]. Đáp ứng với điều trị IFN/P.IFN thì typ gen A tốt hơn D và B tốt hơn C [10]. Trái lại, đáp ứng điều trị giữa các týp gen HBV không khác nhau có ý nghĩa khi điều trị với thuốc uống Nucs. Vì vậy trong lâm sàng người ta không khuyến cáo phải định týp gen HBV trước khi điều trị với Nucs.
4.2. Vai trò của định lượng HBV DNA
Ngoại trừ ở pha 1 (dung nạp miễn dịch) không có chỉ định điều trị, khi có viêm gan B hoạt động dù thể HBeAg dương tính hay âm tính có chỉ định đặc trị thì lượng HBV DNA là một yếu tố thúc đẩy cơ bản của quá trình viêm hoại tử tại gan và trong lâu dài là biến chứng xơ gan, suy gan và ung thư gan [11, 12, 13]. Bởi vậy trên lâm sàng theo dõi dựa vào định lượng HBV DNA có một ý nghĩa tiên lượng nguy cơ rất quan trọng.
Các đột biến tự nhiên của HBV và ý nghĩa lâm sàng. HBV là một virus với cấu trúc di truyền là DNA nhưng trong vòng đời lại trải qua một giai đoạn là RNA (pgRNA) cùng với sự kiểm soát sao chép không chặt chẽ nên các đột biến tự nhiên xẩy ra cao hơn nhiều so với các virus có cấu trúc di truyền là DNA khác. Một số đột biến thường xẩy ra có tính chất làm tăng nguy cơ xơ gan và HCC như các đột biến mất đoạn vùng Pre S1; Pre S2 đột biến kép vùng tiền BCP (A1762T/ G1764A) vv…[14,15,16,17,18]. Các đột biến này cũng thường xẩy ra với typ gen C nhiều hơn với typ gen B.
4.3. Đánh giá tình trạng xơ hóa của gan
Mức độ xơ hóa của gan có ý nghĩa quan trọng trong chỉ định điều trị, theo dõi tiến triển và tiên lượng đáp ứng điều trị cũng như nguy cơ biến chứng của VGV B. Cho đến nay, sinh thiết gan vẫn được xem là tiêu chuẩn vàng để đánh giá tình trạng xơ hóa của gan dù cho còn có nhiều ý kiến phê phán. Gần đây, nhiều kỹ thuật không xâm hại được đề xuất và chấp nhận ở các mức khác nhau đã giúp giảm bớt chỉ định sinh thiết gan nhưng vẫn không thay thế hoàn toàn được sinh thiết gan. Ở Việt nam không bắt buộc sinh thiết gan trước khi điều trị VGV B và thực tế hầu như không thực hiện sinh thiết. Siêu âm dánh giá xơ gan thường kém nhạy và muộn. Một số kỹ thuật khác không xâm hại có thể sử dụng như điểm APRI, Forn, FIB-4 hay Firotest, Actitest hay Fibroscan, ARFI vv…Tuy nhiên các thầy thuốc lâm sàng phải biết đánh giá kết quả đối chiếu với những chỉ số tham khảo khác mà không máy móc dựa vào số liệu kỹthuật đơn thuần. Điều này đòi hỏi kinh nghiệm của các bác sĩ điều trị.
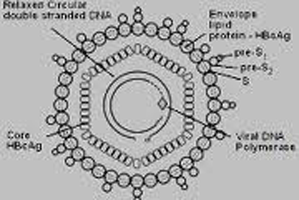
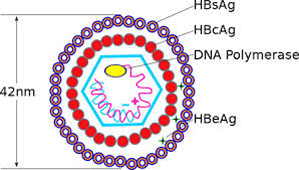
Hình 2. Cấu trúc virus viêm gan B
5. Mục tiêu điều trị viêm gan virus B
Cơ sở để đề ra mục tiêu điều trị và chỉ định điều trị đặc hiệu.
Trước khi đi vào cụ thể xử lý VGV B cần nhắc qua một số khái niệm cơ bản :
5. 1. Một khi đã bị nhiễm Virus viêm gan B (HBV) thì trên thực tế hầu như không thể chữa khỏi hoàn toàn với các thuốc hiện có
Lý do là do HBV trong vòng đời có một giai đoạn hình thành cccDNA tồn tại trong tế bào gan bị nhiễm như một nhiễm sắc thể nhỏ (mini chromosome) mà các thuốc đồng phân Nucleos/ides (Nucs) hiện nay hầu như không có khả năng loại bỏ và các thuốc nhóm Interferon cũng chỉ có ảnh hưởng rất hạn chế. Ngoài ra còn có các đoạn DNA của HBV tích hợp rất sớm vào các vị trí ngẫu nhiên trên nhiễm sắc thể của tế bào vật chủ vĩnh viễn và có thể gây các tác hại khác nhau lâu dài.
Vì vậy mục đích điều trị VGV B hiện nay là ngăn chặn, hạn chế các thương tổn của gan để giảm thiểu/tránh các biến chứng nguy hiểm về lâu dài như xơ gan, suy gan và HCC.
5.2. Bản thân HBV tự nó không phải là một virus gây nên bệnh lý cho tế bào bị nhiễm (cytopathogenic virus)
Vì thế nên sự có mặt HBV dù với số lượng lớn cũng không phải là lý do đủ để chỉ định điều trị (như trong pha dung nạp miễn dịch là điển hình).
5.3. Bệnh lý viêm hoại tử tế bào gan trong VGV B là một bệnh lý miễn dịch giữa hệ thống miễn dịch của vật chủ chống lại các kháng nguyên virus
Giảm tải lượng HBV bằng các thuốc ức chế virus giúp làm giảm tổn thương tại gan và hạn chế/ ngăn ngừa các biến chứng lâu dài như xơ gan, suy gan và HCC.
5.4. Men ALT là một men tương đối đặc hiệu của tế bào gan
Nên khi tổn thương tế bào gan men ALT được giải phóng và tăng cao trong máu. Tuy nhiên có khoảng 25% bệnh nhân VGV B có tổn thương gan tiến triển nhưng men ALT lại bình thường đặc biệt hay gặp ở nhóm bệnh nhân >40 tuổi.
Bởi vậy, trên lâm sàng khi ALT bình thường không luôn luôn đồng nghĩa với gan đang không có tổn thương tiến triển.
5.5. Mục tiêu điều trị cụ thể
Mục tiêu điều trị là nhằm mang lại tuổi thọ và chất lượng cuộc sống gần như những người không nhiễm HBV bằng cách hạn chế, ngăn ngừa tình trạng viêm gan hoạt động, xơ hóa xan, xơ gan, suy gan và ung thư gan.
Trong các nghiên cứu lâm sàng và thực hành lâm sàng người ta đã chứng minh được rằng các mục tiêu trên có thể đạt được nếu điều trị dẫn đến khống chế lượng HBV DNA đạt đến mức thấp nhất (không phát hiện với kỹ thuật PCR) và kéo dài vĩnh viễn (bằng duy trì đáp ứng hay đáp ứng bền vững: maintained response or sustained response).
Mục tiêu lý tưởng là mất HBsAg với có hoặc không anti HBs ( được xem gần như lành bệnh) là còn quá cao đối với khả năng của các thuốc hiện có nên chỉ đặt hướng cho phấn đấu trong tương lai!
6. Các thuốc đặc trị HBV đang được sử dụng
Các thuốc hiện có trên thị trường dựa vào tác dụng điều trị được chia làm 2 nhóm:
- Nhóm thuốc điều hòa miễn dịch bao gồm: Interferon ( chuẩn hay gắn PEG) và Thymosin α.
- Nhóm thuốc ức chế trực tiếp HBV gồm 3 dòng:
+ Dòng L nucleoside.
+ Dòng D cyclopentane.
+ Dòng Acyclic nucleotide phosphonate.
6.1. Nhóm thuốc điều hòa miễn dịch
6.1.1. Interferon α chuẩn
Điều trị trên bênh nhân VGV B có HBeAg dương tính. Trong nghiên cứu gộp, phân nhóm có điều trị với Interferon α liều 5MU hàng ngày hay 10MU x 3/ tuần trong thời gian từ 4 – 6 tháng kết quả cho thấy tỷ lệ chuyển đổi huyết thanh HBeAg, ức chế sao chép HBV, hạ men ALT đều cao hơn nhóm chứng không điều trị có ý nghĩa thống kê [19]. Với bệnh nhân người châu Á với liều dùng 5MU đến 6MU x 3/tuần cũng mang lại kết quả tương đương [20]. Theo dõi lâu dài những bệnh nhân có đáp ứng tỷ lệ xơ gan và HCC giảm hơn nhóm chứng có ý nghĩa [20,21].
Điều trị trên bệnh nhân có HBeAg âm tính. Khi điều trị với IFN hiệu quả về đáp ứng virus và đáp ứng sinh hóa đều cao hơn nhóm chứng có ý nghĩa thống kê [22]. Tuy nhiên có sự khác nhau về sắc tộc, các bệnh nhân gốc Âu châu có kết quả cao hơn bệnh nhân gốc Á châu. Thời gian điều trị đối với nhóm này là 12 tháng ( dài hơn so với nhóm bệnh nhân có HBeAg+). Theo dõi lâu dài, những bệnh nhân được điều trị với IFN và có đáp ứng thì giảm được nguy cơ xơ gan, HCC và tăng thời gian sống nói chung. Đặc biệt, nhóm bệnh nhân đã chớm xơ gan mà chưc năng còn bù trừ tốt thì hiệu quả về ngăn ngừa biến chứng lâu dài và thời gian sống thêm cũng không thua kém mà có khi còn tốt hơn nhóm bệnh nhân chưa xơ gan [19,23]. Do đó, xơ gan còn bù trừ tốt không phải là một chống chỉ định điều trị với IFN. Ngược lại, những bệnh nhân xơ gan mất bù thì chống hỉ định điều trị với IFN vì có nguy cơ bùng phát suy gan và dẫn đến tử vong do điều tri .
6.1.2. Pegylated Interferon ( P.IFN)
P.IFN là IFN được gắn thêm một gốc Poly Ethylene Glycol làm cho thời gian bán hủy của IFN và hoạt tính sinh học của nó trong cơ thể được kéo dài và nồng độ thuốc ổn định nên chỉ cần tiêm thuốc mỗi tuần 1 lần mà hiệu quả cao hơn IFN chuẩn khoảng 50% [24].
- Điều trị bệnh nhân VGV B có HBeAg dương tính.
Nghiên cứu điều trị với P.IFN α2a liều 180ug/ tuần x 48 tuần có hoặc không kèm với Lamivudine cho những kết quả như sau:
Đáp ứng điều trị bền vững (tiêu chuẩn: chuyển đổi huyết thanh eAg, ALT bình thường, HBV-DNA <104 cps/ml ở thời điểm 24 tuần sau khi ngưng điều trị) đạt 33% và có 3% sạch HBsAg [25]. Nghiên cứu NEPTUNE gần đây nhằm tìm thời gian và liều lượng tối ưu của P.IFN α 2a xác nhận liều 180ug/ tuần x 48 tuần là có hiệu quả tối ưu [26]. Điều đặc biệt là theo dõi lâu dài sau điều trị hiệu quả vẫn còn tiếp tục làm tang thêm tỷ lệ chuyển đổi huyết thanh eAg và sạch HBsAg [27]. Kết quả nghiên cứu với P.IFNa2b với liều 1,0 và 1,5ug/kg cân nặng cũng cho kết quả tương đương [28].
- Điều trị bệnh nhân có HBeAg âm tính.
Đáp ứng điều trị với P.IFN của nhóm bệnh nhân này cũng tương tự như bệnh nhân có HBeAg dương tính [29].
- Bệnh nhân xơ gan còn bù tốt vẫn được chỉ định điều trị với P.IFN
Kết quả có phần tốt hơn so với bệnh nhân chưa xơ gan và trên mô học tình trạng xơ gan có cải thiện [30].
- Yếu tố tiền lượng đáp ứng điều trị với IFN nói chung:
Những yếu tố có trước khi bắt đầu điều trị:
+ Typ gen của HBV: Typ gen A tốt hơn typ gen D, typ gen B tốt hơn typ gen C [31]
+ Tải lượng HBV ban đầu thấp < 107 cps/ ml.
+ ALT cao gấp 2 đến 5 lần giới hạn trên của bình thường (ULN).
Vai trò của IL28B trong đáp ứng của điều trị HBV còn chưa rõ ràng! [32,33]
Những yếu tố biết thêm về tiên lượng đáp ứng trong quá trình điều trị:
+ Mức lượng HBsAg (qHBsAg) trong điều trị: qHBsAg ở thời điểm đã được điều trị 12 tuần và 24 tuần có ý nghĩa tiên đoán cao. Nếu sau 12 hay 24 tuần điều trị P.IFN mà qHBsAg <1.500iu/ml thì tỷ lệ có đáp ứng bền vững (24 tuần sau ngưng điều trị) cao hẳn so với nhóm còn lại. Cũng ở thời điểm đó nếu qHBsAg còn >20.000iu/ml thì hầu như không có hy vọng đạt được đáp ứng bền vững [34].
+ Thay đổi qHBsAg trong điều trị: Nếu sau 12 tuần điều trị mà qHBsAg không giảm >10% thì tỷ lế không đápứng sẽ rất cao từ 80% đến 97% [35,36].
- Những phản ứng không mong muốn có thể xẩy ra khi điều trị với IFN/P.IFN
Thuốc IFN nói chung là nhóm thuốc khi tiêm cho bệnh nhân có nhiều phản ứng không mong muốn. Tuy nhiên các phản ứng này xẩy ra ở bệnh nhân VGV B có tỷ lệ và cường độ thấp hơn so với khi điều trị ở bệnh nhân VGV C. Chỉ khoảng <10% bệnh nhân phải ngưng điều trị do phản ứng với thuốc mà các biện pháp thay đổi liều tiêm, thêm thuốc hỗ trợ vv.. không mang lại kết quả.Các phản ứng này bao gồm: hội chứng giả cúm, chán ăn, sụt cân, da khô, rụng tóc, ngứa, ho vv…bệnh nhân nhận biết được và các tác động của thuốc lên tủy xương và tế bào máu thì nhận biết qua xét nghiệm như giảm bạch cầu đa nhân, giảm tiểu cầu (thường liên quan với IFN/P.IFN) và giảm hồng cầu, hemoglobin (thường liên quan với Ribaverin). Các bệnh nhân xơ gan thường có rối loạn về huyết học nhiều hơn và nặng hơn.
6.1.3. Kết hợp điều trị P.IFN và thuốc uồng (Nucleis/tides : Nucs)
Đây là một ý tưởng hay, hai nhóm thuốc có cơ chế tác dụng khác nhau khi kết hợp có thể mang lại hiêu quả hiệp lực. Tuy nhiên, cho đến hiện nay mặc dù có rất nhiều cách kết hợp khác nhau như thay thế, tiếp nối, bổ sung thêm, dẫn nhập vv…chưa có được một cách kết hợp nào mang lại bằng chứng là có kết quả nổi bật và được đông đảo chấp nhận. Bởi vậy, các công thức kết hợp điều trị vẫn chỉ ở trong giai đoạn nghiên cứu mà thôi! [37,38,39,40]. Các thầy thuốc lâm sàng còn phải chờ đợi các kết quả nghiên cứu thêm.
6.1.4. Thuốc Thymosin Alpha
Thymosin Alpha là một Polypeptide gồm 28 axid amin được tổng hợp tại tuyến ức (Thymus) có tác dụng kích thích miễn dịch tế bào của cơ thể. Chỉ một số nước ở chấu Á chấp nhân cho điều trị bệnh nhân VGV B với Thymosin Alpha. Số lượng nghiên cứu được công bố còn rất ít so với nghiên cứu điều trị bằng IFN/P.IFN. Một nghiên cứu gộp từ 5 công trình nghiên cứu ngẫu nhiên đối chứng gồm 353 bệnh nhân với liều 1,6mg x 2 lần/ tuần trong 24 tuần cho thấy chỉsau khi ngưng điều trị 1 năm thì tỷ lệ có đáp ứng mới cao hơn nhóm chứng có ý nghĩa [41].
Kết luận chung về các thuốc điều biến miễn dịch
- Ưu điểm là có giới hạn thời gian điều trị.
- So với nhóm chứng thì nhóm điều trị có đáp ứng cao hơn.
- Cho đến nay các nghiên cứu về thuốc điều biến miễn dịch tuyệt đại đa số là thuốc IFN/P.IFN
- Hiệu quả điều trị với P.IFN tốt hơn rõ rệt so với IFN chuẩn.
6.2. Nhóm thuốc Nucleos/tides (Nucs)
Các thuốc Nucs hiện đã được công nhận sử dụng trên lâm sàng phổ biến về đặc điểm cấu tạo được chia làm 3 dòng:
- Dòng L- Nucleoside gồm có các thuốc: Lamivudine, Telbivudine, Clevudine nhưng tại Việt Nam ttên thị trường chỉ có Lamivudine.
- Dòng D-Cyclopentane có Entecavir.
- Dòng Acyclic Nucleotide Phosphonate: có Adefovir và Tenofovir.
Tuy là 3 dòng thuốc nhưng đều có tác dụng trên một mục tiêu đó là ức chế sao chép của HBV trên men Polymerase ở những đặc hiệu khác nhau. Do đó các thuốc này khi kết hợp không làm tăng khả năng ức chế HBV song có thể phối hợp/ thay thế để đề phòng kháng thuốc hay khi đã có đề kháng thuốc thuộc nhóm khác. Hai đặc điểm quan trọng trong chọn lựa thuốc đầu tay là hiệu lực (potent) và rào cản di truyền (genetic barrier) kháng thuốc.
Hiệu lực của thuốc được thể hiện trên lâm sàng bằng mức giảm HBV-DNA tính theo log10 sau 1 năm điều trị trên các bệnh nhân mới.
Rào cản di truyền được định nghỉa là số đột biến điểm đặc hiệu cần thiết để HBV trở nên đề kháng với thuốc.
6.2.1. Lamivudine
Lamivudine là thuốc thuộc dòng Nucleoside đầu tiên được chấp thuận trung điều trị VGV B mạn tính. Lamivudine có hiệu lực làm giảm HBV-DNA khoảng gần 5log sau 1 năm điều trị và có rào cản di truyền kháng thuốc thấp là 1.
- Hiệu quả điều trị với VGV B có HBeAg+:
Bệnh nhân được điều trị với Lamivudine có làm giảm ALT, giảm HBV-DNA , cải thiện tổn thương mô học và có chuyển đổi huyết thanh HBeAg khoảng 20% sau 1 năm. Tỷ lệ này tăng dần với kéo dài thời gian điều trị sau 4 đến 5 năm [42,43]. Nhược điểm chính của Lamivudine là có tỷ lệ kháng thuốc cao khoảng 15% đến 20% mỗi năm, khoảng 5 năm sau điều trị tỷ lệ kháng thuốc tăng đến 70% [43,44] và khi có kháng thuốc thì hiệu quảđiều trị đã thu được cũng giảm đi [45]. Ngưng thuốc sau chuyển đổi huyết thanh HBeAg < 12 tháng tỷ lệ tái phát rất cao [46,47] nên thường được khuyến cáo chỉ ngưng thuốc sau chuyển đổi huyết thanh HBeAg ít nhất là 12 tháng (dù vậy tỷ lệtái phát vẫn vào khoảng 50%.
- Hiệu quả điều trị với VGV B có HBeAg âm tính
Tác dụng trên ALT, HBV-DNA, mô học của gan cũng tượng tự như nhóm bệnh nhân có HBeAg+. Ngưng thuốc ở nhóm bệnh nhân này có tỷ lệ tái phát cao hơn nên phải điều trị lâu dài nếu không có chống chỉ định. Nếu cần, điều kiện để xét ngưng thuốc là khi đạt được HNB-DNA âm tính (với kỹ thuật PCR) kéo dài liên tiếp ít nhất trong 3 lần xét nghiệm cách nhau mỗi 6 tháng – mặc dù vậy tỷ lệ tái phát cũng lên đế trên 50% [48,49,50]. Lamivudine là một thuốc có độ an toàn cao, có thể sử dụng cho bệnh nhân xơ gan mất bù và cũng an toàn cho thai nhi (trong thực tế) nên khi cần có thể dùng cho cả phụ nữ mang thai.
6.2.2. Telbivudine
Cũng thuộc dòng L-Nucleoside như Lamivudine có hiệu lực mạnh hơn (giảm khoảng 6log) và rào cản di truyền kháng thuốc cũng chỉ là 1; Telbivudine có kháng chéo với Lamivudine. Sau 2 năm sử dụng có 17% bệnh nhân có kháng với thuốc Telbivudine. Tóm lại Telbivudine là một thuốc có hiệu lực mạnh nhưng rào cản di truyền thấp. Thuốc này chưa có mặt tại Việt nam.
6.2.3. Entecavir
Entecavir thuộc dòng D-Cyclopentane là thuốc có hiệu lực mạnh làm giảm HBV-DNA >6log sau 1 năm điều trị. Thuốc có rào cản di truyền kháng thuốc cao là 3. Trên lâm sàng, sau 5 năm điều trị tỷ lệ kháng thuốc chỉ là 1,2% [51]. Khi điều trị cũng làm giảm ALT, HBV-DNA, cải thiện tỗn thương mô gan và chuyển đổi huyết thanh HBeAg khoảng 20% sau một năm. Tuy nhiên, khi đã kháng với Lamivudine, Telbivudine (vì có các đột biến kháng trùng với nhau) thì tỷ lệkháng Entecavir lên đến 50% sau 5 năm điều trị [52,53,54,55]. Vì vậy, chuyển sang Entecavir không phải là một biện pháp tốt khi đã có kháng với Lamivudine hay Telbivudine.
6.2.4. Adefovir
Adefovir thuộc dòng Nucleotide là thuốc thứ 2 sau Lamivudine được phép sử dụng trong điều tri VGV B mạn. Adefovir có hiệu lực thấp nhất trong các thuốc hiện có, giảm HBV-DNA sau 1 năm điều trị chỉ khoảng gần được 4 log, rào cản di truyền kháng thuốc cũng chỉ là 1. Trong 2 năm đầu sử dụng tỷ lệ kháng thuốc chỉ khoảng 3% nhưng sau đó tỷ lệkháng tang nhanh và đạt đến 29% sau 5 năm [56]. Không có kháng chéo với Lamivudine,Telbivudine nên có thể điều trịbổ sung cho 2 thuốc này khi có kháng thuốc.
6.2.5. Tenofovir
Thuộc nhóm Nucleotide có hiệu lực ức chế HBV cao, sau 1 năm điều trị HBV-DNA giảm >6log. Cho đến nay, các kết quả điều trị sau 5 năm chưa xác định được kháng thuốc đặc hiệu kiểu gen [57,58].
7. Nhóm bệnh nhân đặc biệt
7.1. Thai phụ
Phụ nữ trong lớp tuổi sinh đẻ nếu có chỉ định điều trị VGV B cần phải trao đổi kỹ về các thuận lợi và trở ngại khi dùng các thuốc đặc trị HBV.
Nhóm thuốc Interferon có thuận lợi là có thời gian điều trị giới hạn, tuy nhiên chỉ khoảng 1/3 đạt được kết quả bền vững tương đối. Khi mang thai hay có ý định mang thai có chống chỉ định dùng Interferon.
Nhóm thuốc Nucs hầu hết phải dùng lâu dài và khó xác định thời gian kết thúc nên không thể chờ đến khi ngưng thuốc mới mang thai. Thuốc uống có tính an toàn rất cao đối với người sử dụng. Ảnh hưởng của thuốc với thai nhi thì thuốc Telbivudine và Tenofovir thuộc lớp B [59,60,61] còn các thuốc Lamivudine, Adefovir, Entecavir thuộc lớp C. Tuy nhiên đã có những kết quả lâm sàng cho thấy Lamivudine an toàn với thai nhi và làm giảm tỷ lệ lây truyền từ thai phụ có lượng HBV-DNA cao sang trẻ sơ sinh [59].
7.2. Bệnh nhân có đồng nhiễm với các virus khác như HCV, HIV, HDV
Do đường lây nhiễm giữa các virus này là giống nhau cho nên nguy cơ đồng nhiễm là cao. Do đó, một khi đã chẩn đoán nhiễm HBV cần tầm soát đồng nhiễm với các virus khác để có quyết định điều trị thích hợp. Ở Việt nam thường không quan tâm sự đồng nhiễm giữa HBV và HDV. Gần đây, nghiên cứu của L Dunfort và cs HDV có đồng nhiễm vói HBV ở Việt nam lên đến >10 % nên cần xem lại vấn đề này trong tương lai [62].
7.3. Bệnh nhân đã ở giai đoạn xơ gan mất bù
Xơ gan mất bù là giai đoạn cuối của biến chứng xơ gan do HBV. Trong trường hợp này chống chỉ định dùng Interferon vì có thể dân đến bùng phát suy gan dẫn đến tử vong. Ngựơc lại, chúng ta có thể sử dụng trong các thuốc Nucs để ngăn ngừa suy gan trong lúc chờ đợi gan phục hồi hay ghép gan. Chỉ định điều trị ở đây là với mọi trường hợp nếu phát hiện có HBV-DNA dương tính với kỹ thuật có độ nhạy cao bất kể mức ALT. Do thời gian điều trị phải lâu dài nên ưu tiên dùng các thuốc có hàng rào di truyền kháng thuốc cao [58,59,63].
7.4. Bệnh nhân tuổi thiếu nhi
Trên diễn tiến tự nhiên, HBV rất ít khi hoạt động gây thương tổn gan ở trẻ em. Bởi vậy, cần chẩn đoán phân biệt kỹ lưỡng với các nguyên nhân có thể gây tổn thương gan khác và theo dõi chặt chẽ trước khi chỉ định điều tri với thuốc đặc hiệu HBV. Theo hướng dẫn sử dụng thuốc đặc hiệu, hiện nay có thể dùng Interferon cho trẻ từ sau 12 tháng tuổi [64], Lamivudine cho trẻ sau 3 tuổi, Adefovir cho trẻ sau 12 tuổi và Entecavir cho trẻ sau 16 tuổi. Chưa có hướng dẫn sử dụng Peg Interferon và Tenofovir cho trẻ em song ý kiến chuyên gia cho rằng có thể sử dụng một cách thích hợp.
7.5. Bệnh nhân kháng thuốc
HBV không có đột biến kháng thuốc đặc hiệu với Interferon nên có thể sử dụng IFN/P.IFN nếu có chỉ định khi có kháng thuốc với bất kỳ thuốc Nucs nào. Kháng thuốc Nucs là một cản trở chính cho các thuốc uống đăc trị. Nguyên tắc đầu tiên là tránh để xẩy ra kháng thuốc hơn là tìm cách đối phó khi kháng thuốc đã xẩy ra. Để đạt được mục đích này trước tiên tránh lạm dụng chỉ định sử dụng thuốc uống đặc trị (đặc biệt là điều trị trong pha dung nạp miễn dịch!) và khi đã có chỉ định đúng cần lựa chọn thuốc có hiệu lực cao và có rào cản di truyền kháng thuốc cao như Entecavir, Tenofovir nếu được và chỉ dẫn cặn kẽ bệnh nhân tuân thủ dùng thuốc. Nếu dự kiến sẽ phải điều trị lâu dài, tránh dùng đơn trị với các thuốc có rào cản di truyền kháng thuốc thấp như Lamivudin, Telbivudine, Adefovir nhất là ở những bệnh nhân có tải lượng HBV cao (>2x106iu/ml hay >107cps/ml). Một khi kháng thuốc đã xẩy ra, người ta có thể hoặc bổ sung thêm một thuốc mới không có kháng chéo với thuốc đã/đang dùng hoặc thay thế bằng một thuốc mới có hiệu lực cao và có rào cản di truyền kháng thuốc cao mà không có kháng chéo.
7.6. Nhóm bệnh nhân nhiễm HBV mà vì một lý do nào đó phải dùng thuốc giảm miễn dịch hay điều trị hóa chất
Như đã trình bày ở trên, một khi đã bị nhiễm HBV thì virus này sẽ tồn tại gần như vĩnh viễn trong cơ thể ở các thể lâm sàng khác nhau. Các thể lâm sàng này tồn tại nhờ vào sự cân bằng động giữa HBV (tác nhân gây bệnh) và hệ thống miễn dịch của cá thể đó (yếu tố bảo vệ cá thể). Vì vậy, sự cân bằng này có thể bị thay đổi do các yếu tố ngoài tác động vào và nguy cơ tăng hoạt hay tái hoạt của HBV là luôn luôn hiện hữu ở mức độ khác nhau. Nguy cả trong pha mang HBV không hoạt động (inactive carrier) hay thậm chí cả ở thể ẩn (occult hepatitis B) HBV cũng có thể trở thành thể hoạt động. Bởi vậy, tất cả bệnh nhân nhiễm HBV khi dùng thuốc giảm miễn dịch hay điều trị hóa chất cần theo dõi đánh giá tình trạng hoạt động của HBV để có chỉ định điều trị thích hợp và kịp thời. Một yếu tố nguy cơ của bùng phát hoạt động HBV là tải lượng HBV ban đầu >104 cps/ml [65,66]. Điều trị dự phòng trước với thuốc đặc tri HBV có tác dụng ngăn ngừa bùng phát và hạn chế hữu hiệu các biến chứng cho bệnh nhân dùng thuốc giảm miễn dịch hay hóa trị ung thư [65,67]. Do thời gian điều trị dự phòng này thường không kéo dài nên có thể sử dụng Lamivudine [68] nhưng nếu có điều kiện thì dùng các thuốc có hiệu lực mạnh và có rào cản di truyền kháng thuốc cao vẫn an tâm hơn [67].
7.7. Bệnh nhân được chỉ định ghép gan do biến chứng của VGV B
HBV là nguyên nhân chính dẫn đến chỉ định ghép gan của khu vực châu Á (xơ gan mất bù, suy gan cấp, HCC ). HBV có thể tồn tại với số lượng thấp cả trong các tổ chức tế bào ngoài gan cùng với việc phải dùng thuốc giảm miễn dịch sau ghép nên điều trị dự phòng HBV sau ghép gan là bắt buộc phải thực hiện.
Trước đây thường dùng kháng thể chống HBsAg (HBIg) với liều 10.000iu/ tháng vừa tốn kém mà hiệu quả lại hạn chế ngòai ra còn có nguy cơ tạo ra chủng HBV đột biến thoát (escape mutant) không bị kiểm soát bởi kháng thể. Ngày nay xu hướng chuyển sang sử dụng HBIg liều thấp (1000iu/tháng) kèm với các thuốc Nucs hoặc chỉ sử dụng hoàn toàn thuốc Nucs có hiệu lực mạnh và ít kháng đã làm tăng tỷ lệ sống và HBV-DNA âm tính sau ghép gan [69,70,71]
7.8. Bệnh nhân HCC liên quan với HBV
Nhiễm HBV mạn là nguyên nhân chính của HCC ở châu Á thái bình dương [72].Ở Việt nam, tỷ lế HCC có HBsAg dương tính chiếm từ 70% đến 90% [73,74] và nếu tính anti HBc thì tỷ dương tính trong HCC lên đến 93% - 100%. Nhờ các chương trình tầm soát HCC, một số nước đã phát hiện HCC sơm hơn và tỷ lệ điều trị triệt căn cao. Kết quả là thời gian sống sót của bệnh nhân được kéo dài đủ để phát sinh các HCC mới. Nhóm bệnh nhân có HCC tái phát muộn (sau > 2 năm điều trị triệt căn) một nguyên nhân quan trọng là tải lượng HBV >104cps/ml (185). Một sốnghiên cứu gộp và nghiên cứu mới đây cho thấy điều trị giảm tải lương HBV-DNA (với cả IFN và Nucs) làm giảm phát sinh HCC mới và tái phát HCC sau điểu trị triệt căn HCC [75,76,77].
8. Các Khuyến nghị
8.1. Khuyến nghị 1:
Đánh giá toàn diện và tham vấn đầy đủ cho bệnh nhân là điều rất quan trọng trước khi bắt đầu đặc tri.(II A).
Đánh giá bao gồm các xét nghiệm sinh hóa, huyết học, tình trạng nhân lên của HBV (HBeAg, lượng HBV DNA), tình trang xơ hoá tại gan, đồng nhiễm HCV, HIV, HDV. Sử dụng bia rượu và tiền sử gia đình trực hệ về HCC, xơ gan. Tham vấn về phòng tránh lây lan, tuân thủ điều trị kể cả vấn đề tâm lý xã hội.
8.2. Khuyến nghị 2:
Nhiễm Virut Viêm gan B mạn: HBsAg dương tính hơn 6 tháng và ALT bình thường. Tình trạng này chưa phải đặc trị. Theo dõi ALT và siêu âm bụng mỗi 3 -6 tháng.(I A).
Viêm gan virut B mạn: HBsAg dương tính hơn 6 tháng và ALT > 2 lần giới hạn cao của trị số tham chiếu tại phòng xét nghiệm (ULN). Không dùng thuốc hạ men gan khi đang cần theo dõi ALT. Theo dõi men gan mỗi tháng trong 3 tháng, nếu ALT vẫn cao cần cân nhắc chỉ định đặc trị.(I A)
Khi chưa có các số liệu tham chiếu mới về men gan nên căn cứ vào số liệu tham chiếu từ chính phòng thí nghiệm đã dùng. Thuốc hạ men gan không giải quyết được một cách cơ bản bệnh lý do viêm gan B và làm mất dấu hiệu để làm căn cứchỉ định đặc trị.
8.3. Khuyến nghị 3:
Trường hợp HBVDNA cao nhưng ALT thường xuỵên từ 1-2 ULN, đặc biệt ở những bệnh nhân > 40 tuổi cần được xác định mức độ xơ hóa bằng sinh thiết hay các biện pháp không xâm hại (fibroscan, ARFI,APRI, Forn, FIB4 v.v…) (II A).
Những bệnh nhân > 40 tuổi có 1 tỷ lệ đáng kể (khoảng 25%) tuy có tổn thương viêm hoại tử gan rõ ràng nhưng men ALT lại ở trong giới hạn bình thường.
Các biện pháp không xâm hại đánh giá mức xơ hóa gan ngày càng được sử dụng nhiều và tỏ ra đáng tin cậy làm cho chỉđịnh sinh thiết gan được giới hạn lại nhưng không thay thế hoàn toàn được sinh thiết.
8.4. Khuyến nghị 4: Chỉ định điều trị
- Viêm gan B mạn, nếu ALT > 2ULN trong 2-3 lần xét nghiệm cách nhau ≥1 tháng và
- HBVDNA ≥ 20.000IU/ml đối với trường hợp HBeAg(+)
- HBVDNA ≥ 2.000IU/ml đối với trường hợp HBeAg(-)
- Hoặc xác nhận có xơ hóa gan nặng, xơ gan phải được chỉ định đặc trị bất kể ALT ở mức nào (I A). Nếu có dấu hiệu hay đe dọa gan mất bù phải được đặc trị ngay vối thuốc NUCs có hiệu lực cao và rào cản di truyền lớn (I A).
8.5. Khuyến nghị 5:
- Thuốc chọn lựa đầu tiên: Tenofovir 300mg/ngày hay Entecavir 0,5mg/ngày hay PegInterferon Peg-IFNα-2a 180mcg/tuần hay Peg-IFNα-2b 1.5mcg/kg /tuần (IA).
- Lamivudine, adefovir hay Interferon chuẩn vẫn còn có thể sử dụng trong một số hoàn cảnh nhất định (IB).
- Chưa có khuyến cáo cho điều trị phối hợp với Nucleoside/ Nucleotide chỉ dùng trong nghiên cứu (I B). TDF, ETV là các thuốc uống có hiệu lực mạnh đồng thời có rào cản di truyền cao nên được lựa chọn ưu tiên vì hầu hết bệnh nhân phải dùng thuốc uống rất lâu dài. Một số nghiên cứu phối hợp thuốc trong điều trị viên gan B nhưng bằng chứng chưa đủ mạnh để đưa vào bản đồng thuận.
8.6. Khuyến nghị 6:
Trong quá trình điều trị cần theo dõi ALT, HBeAg, HBV-DNA mỗi 3 tháng (IA). Theo dõi chức năng thận nếu sử dụng TDF (IA). Nếu dùng IFN hay PegIFN cần theo dõi công thức máu và các tác dụng ngoại ý khác (IA).
8.7. Khuyến nghị 7:
Sau khi dứt điều trị, cần theo dõi ALT và HBVDNA mỗi 1 tháng trong 3 tháng đầu để xem có tái phát sớm hay không và sau đó theo dõi môi 3-6 tháng (II A).
8.8. Khuyến nghị 8: Thời gian điều trị
- Điều trị bằng IFN cổ điển
+ Viêm gan B mạn HBeAg dương: thời gian điều trị 6 tháng (I-A)
+ Viêm gan B mạn HBeAg âm: tối thiểu 12 tháng (I-A)
- Đối với PEG-IFN:
+ Thời gian khuyến cáo 12 tháng (I-A)
+ Với cả Peg-IFNα-2a (40kD) và Peg-IFNα-2b (12kD)
8.9. Khuyến nghị 9:
Về điều trị thuốc nhóm tương tự nucleos(t)ides, thời gian điều trị NUCs và tiêu chuẩn ngừng thuốc
- Bệnh nhân Viêm gan B mạn HBeAg dương:
Ngừng thuốc khi có chuyển đổi HBeAg kèm với HBVDNA âm, duy trì được ít nhất 12 tháng (II-A)
- Bệnh nhân Viêm gan B mạn HBeAg âm:
Nếu HBsAg vẫn còn dương:
+ Không xác định được thời điểm ngừng điều trị.
Tuy nhiên có thể xét để cho ngừng thuốc nếu đồng thời có :
+ Đã được dùng thuốc tối thiểu 2 năm
+ Và đạt HBVDNA âm tính trong 3 lần liên tiếp cách nhau mỗi 6 tháng (II-A)
+ Theo dõi sát tái phát sau ngừng thuốc, nhất là bệnh nhân xơ hóa gan nặng.
+ Mỗi tháng trong 3 tháng đầu
+ Mỗi 3 tháng trong năm đầu
+ Mỗi 6 tháng hay khi có thay đổi sức khỏe.
Khi bệnh nhân tuân thủ tốt nhưng không đạt đáp ứng tiên phát sau 3 tháng hay có đáp ứng không đầy đủ sau 6 tháng:
+ Chuyển sang thuốc hoạt lực mạnh hơn hay
+ Thêm thuốc không có tính chất kháng chéo (bảng) (I A).
Với bệnh nhân có HBeAg âm tính các khuyến cáo của AASLD, EASL đều nêu dung thuốc đến khi sạch HBsAg. Ngừng thuốc ở bệnh nhân viêm gan B có HBeAg âm theo đúng khuyến cáo của APASL có tỷ lệ ta1qi phát khoảng 50% vì vậy vẫn phải theo dõi sát sau đó. Bệnh nhân đã có xơ gan không nên ngưng.
8.10. Khuyến nghị 10:
Điều trị cho phụ nữ tuổi hoạt động sinh dục
- Đối với Phụ nữ tuổi còn mang thai (Child-bearing age):
+ Khi khởi sự điều trị cho phụ nữ chưa mang thai:
Cân nhắc các yếu tố: chỉ định, tính chất thuốc, thời gian điều trị khi khởi sự điều trị
Không mang thai có thời hạn để điều trị với Peg-IFN hay Chọn NUCs có ảnh hưởng thấp nhất cho thai.
Thuốc độc tính thai nhóm B theo FDA (không gây độc cho sinh vật thí nghiệm nhưng chưa biết trên người): TDF, LdT.
Thuốc độc tính thai Nhóm C (gây quái thai cho sinh vật nhưng chưa rõ tác dụng trên người): LAM, ADV, ETV
+ Trường hợp đang mang thai, chưa điều trị:
Cần dùng LAM, hay TDF vào tam cá nguyệt cuối nếu HBVDNA >2x106 IU/ml để phòng lây mẹ con.
- Điều trị cho phụ nữ trong tuổi sinh đẻ.
Tình trạng chưa mang thai:
+ IFN được khuyến khích chọn đầu tiên cho phụ nữ chưa có thai (I B).
+ Khuyến cáo bệnh nhân không được mang thai khi đang dùng IFN (I-A).
Tình trạng đang mang thai:
+ Dùng thuốc nhóm tương tự nucleos(t)ide có độc tính thai nhóm B (II-A).
- Đề phòng lây dọc từ mẹ sang con cho phụ nữ mang thai
Nếu HBVDNA cao (>2x106IU/ml) Dùng TDF vào tam cá nguyệt cuối (II-A)
8.11. Khuyến nghị 11:
Điều trị cho bệnh nhân viêm gan B mạn đồng nhiễm HIV
Tất cả bệnh nhân nên được cân nhắc điều trị đặc hiệu viêm gan B mạn nếu có 1 trong các tình huống sau:
- HBVDNA >2000IU/ml (>10.000 cps/ml)
- Có viêm hoại tử đáng kể ở gan
- Có xơ hóa gan (Fibrosis)
Phác đồ chọn lựa điều trị:
+ Nếu CD4+>500: chưa có chỉ định ART: ADV hay Peg-IFN (II-A). (Tránh TDF, LAM)
+ Nếu CD4+< 500: có chỉ định ART: Nên chọn công thức ART có TDF (TDF+FTC/LAM)
8.12. Khuyến nghị 12:
Điều trị cho bệnh nhân viêm gan B mạn đồng nhiễm HCV hay HDV
Cần xác định tác nhân nào nổi trội hơn để điều trị (I-A)
8.13. Khuyến nghị 13:
Điều trị cho bệnh nhân viêm gan B mạn có bệnh gan mất bù
- Chống chỉ định IFN (gây kích phát viêm gan, mất bù gan)(I A)
- Nucs có hoạt lực mạnh và ức chế nhanh HBV phải được dùng ngay (ETV, TDF) (II A).
- Theo dõi bắt buộc chức năng thận, toan lactic máu, nhất là bệnh nhân có điểm MELD >20 (III-A)
8.14. Khuyến nghị 14:
Vấn đề kháng thuốc
Trong trường hợp kháng thuôc NUCs, nếu
- Kháng LAM: chuyển qua TDF (IA) hay có thể phối hợp thêm ADV (IA).
- Kháng ADV: chuyển qua TDF (IIA) hoặc ETV (IA) hay phối hợp thêm LAM hoặc ETV (IA).
- Kháng ETV: chuyển qua TDF (IIA) hay phối hợp thêm TDF (IA) (trường hợp xơ gan nặng, cần phối hợp ETV+TDF trong 3 tháng trước khi chuyển qua TDF).
- Kháng LAM+ADV: cần xét nghiệm giải trình tự để xác định kháng thuốc, dùng phối hợp ETV+TDF (IIA)
- Đáp ứng một phần với TDF: phối hợp thêm ETV hay chuyển qua ETV (IIIB).
- Có thể chuyển qua dùng IFN hoặc PEG-IFN trong trường hợp kháng LAM (IA) hay các NUCs khác (IIIA).
8.15. Khuyến nghị 15:
Sử dụng thuốc ức chế miễn dịch trên bệnh nhân viêm gan B
- Trước khi dùng thuốc ức chế miễn dịch hay hóa trị liệu, cần kiểm tra HBsAg (IA). Nếu HBsAg(+), sử dụng ETV hay TDF (IIIA) trước 1 tháng để phòng viêm gan bùng phát. Duy trì điều trị 6 tháng sau khi dứt hóa trị hay ức chếMD.
- Trước khi dùng anti-CD20 rituximab hay anti-TNFα, nếu HBsAg(-) cần kiểm tra HBcAb. Nếu HBcAb(+), theo dõi HBVDNA để điều trị (IIIA).
8.16. Khuyến nghị 16:
Viêm gan B và ghép gan
- Tất cả bệnh nhân chờ ghép cơ quan đều phải dùng NUCs nếu HBVDNA(+) (IIA). Nếu ghép gan: LAM+HBIg (IIA) hay LAM+ADV hay ETV (IIA)
- 12 tháng sau ghép: HBIg hay ADV (IIA), nếu nguy cơ thấp, có thể dùng LAM (IB)
- Nếu nhận gan từ người cho gan có HBcAb(+): LAM, ETV, TDF hay HBIg và cần được điều trị lâu dài (IIIA).
Việc dùng các thuốc NUCs đã giúp giảm đến 90% liều HBIg sử dụng sau ghép gan liên quan với HBV vừa đỡ tốn kém mà còn giúp cho sống còn lâu dài sau ghép tăng lên.
Ý kiến các chuyên gia cho rằng việc thay thế LAM bằng các thuốc ETV, TDF sẽ tốt hơn nhưng các số liệu còn ít do thuốc mới lưu hành sau này so với LAM.
8.17. Khuyến nghị 17:
Viêm gan B và ung thư gan
Đối với bệnh nhân ung thư gan: khi có lượng HBV DNA >2000iu/ml phải được điều trị với ETV hay TDF lâu dài (IA) trước và/ hay sau khi điều trị HCC (II B). Điều trị dự phòng HBV nên được tiến hành trên bệnh nhân điều trị TACE (II A). Tất cả bệnh nhân HCC có HBsAg dương tính cần được theo dõi HBV DNA để có xử trí thích hợp (II B).
Những nghiên cứu gần đây cho thấy HBV có thể tái hoạt, bùng phát trên bệnh nhân HCC liên quan với HBV. Điều trịthích hợp HBV làm giảm tỷ lệ suy gan sau can thiệp và làm giảm tỷ lệ tái phát muộn HCC sau can thiệp điều trị.
Đây là bản đồng thuận đầu tiên về xử lý viêm gan virus B của Việt nam nên nhất định còn nhiều thiếu sót, mong các đồng nghiệp góp ý để những bản cập nhật sau này được tốt hơn
Hội Gan Mật Việt Nam