Tyrosine kinase, chức năng sinh học và vai trò trong bệnh ung thư
Khái niệm
Trong hóa sinh, kinase là một dạng enzyme có chức năng chuyển nhóm phosphate từ các phân tử cao năng lượng (ATP) tới một phân tử đích là protein đặc hiệu. Quá trình này gọi là sự phosphoryl hóa protein. Ngược lại các phosphatase là các enzyme gỡ nhóm phosphate này ra khỏi phân tử protein.
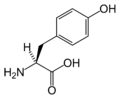
Enzyme kinase đặc hiệu cho việc chuyển nhóm phosphate của các phân tử cao năng cho các acid amin Tyrosines được gọi là Tyrosine kinases.
Tyrosine kinase là một enzyme có chức năng chuyển một nhóm phosphate từ ATP sang acid amin Tyrosine ở phân tử protein trong tế bào. Nó hoạt động như một công tắc “bật” hoặc “tắt” trong nhiều chức năng. Nhóm phosphat được gắn vào acid amin tyrosine trong phân tử protein làm phân tử protein này được phosphoryl hóa. Tyrosine kinase là một nhóm nhỏ của lớp protein kinase, lớp protein kinase này ngoài việc phosphoryl hóa các protein có Tyrosine, nó còn phosphoryl hóa các phân tử protein có các axit amin khác như serine và threonine. Phosphryl hóa protein bởi kinase là một cơ chế quan trọng trong việc truyền tín hiệu trong một tế bào và điều chỉnh hoạt động của tế bào, chẳng hạn như phân chia và tăng trưởng tế bào.
Protein Kinase có thể bị đột biến, bị kẹt ở vị trí "bật" và gây ra sự tăng trưởng không được kiểm soát của tế bào, đây là một bước cần thiết cho sự phát triển của ung thư. Do đó, các chất ức chế kinase (như imatinib), thường là phương pháp điều trị ung thư hiệu quả.
Hầu hết các tyrosine kinase có một protein tyrosine phosphatase liên quan, loại bỏ nhóm phosphate.
Phản ứng
Protein kinase là một nhóm các enzyme có tiểu đơn vị xúc tác chuyển gamma (ở đầu cuối) phosphate từ nucleoside triphosphate (thường là ATP) sang một hoặc nhiều acid amin trong chuỗi bên của cơ chất protein làm thay đổi cấu trúc protein và dẫn đến chức năng của protein. Các enzyme nằm trong hai lớp rộng, đặc trưng cho tính đặc hiệu cơ chất: đặc hiệu serine/threonine và đặc hiệu tyrosine.
Chức năng
Như trên đã nói, thuật ngữ kinase mô tả một họ lớn các enzyme chịu trách nhiệm xúc tác cho việc chuyển một nhóm phosphat từ một phân tử cao năng triphosphate nucleoside (như ATP) sang một phân tử chất nhận. Tyrosine kinase xúc tác quá trình phosphoryl hóa tyrosine trong phân tử protein. Sự phosphoryl hóa tyrosine lần lượt gây ra sự thay đổi chức năng của protein mà chúng nhận được nhóm phosphat.
Tyrosine được phosphoryl hóa có chức năng kiểm soát một loạt các tính chất của phân tử protein (như hoạt động của enzyme) và sự tương tác giữa các phân tử với nhau. Hơn nữa, tyrosine kinase hoạt động trong nhiều tầng tải tín hiệu, trong đó tín hiệu ngoại bào được truyền qua màng tế bào đến tế bào chất và thường đến nhân, nơi biểu hiện gen có thể bị thay đổi. Cuối cùng, đột biến có thể khiến một số tyrosine kinase hoạt động mạnh mẽ, một trạng thái chức năng không ngừng nghỉ có thể góp phần vào sự khởi đầu hoặc tiến triển của ung thư.
Tyrosine kinase hoạt động trong một loạt các quá trình, các con đường truyền tín hiệu và hoạt động của tế bào, và chịu trách nhiệm cho các sự kiện quan trọng trong cơ thể. Tyrosine kinase màng tế bào có chức năng truyền tín hiệu xuyên màng và tyrosine kinase trong tế bào truyền tín hiệu đến nhân. Hoạt động của Tyrosine kinase trong nhân tế bào liên quan đến kiểm soát chu kỳ tế bào và tính chất của các yếu tố phiên mã. Theo cách này, hoạt động của tyrosine kinase có liên quan đến quá trình phân bào, gây ra quá trình nguyên phân trong tế bào; protein trong tế bào chất và protein trong nhân được phosphoryl hóa ở acid amin tyrosine trong quá trình này. Như vậy, sự tăng trưởng và sinh sản của tế bào phụ thuộc vào tyrosine kinase. Chức năng Tyrosine kinase đã được quan sát trong hoạt động của nhân tế bào, không phải ở chất nhiễm sắc mà ở lớp vỏ của nhân và ở mạng lưới sợi có chức năng ổn định cấu trúc DNA. Cụ thể, Lyn, một loại kinase thuộc họ Src được xác định trong hoạt động của nhân tế bào, có vai trò kiểm soát chu kỳ tế bào. Tycine tyrosine kinase thể hiện rất nhiều chức năng. Vai trò của tyrosine kinase họ Src thay đổi đáng kể tùy theo loại tế bào, cũng như quá trình phát triển và biệt hóa tế bào. Các tyrosine kinase của Lyn và Src đã được biết là có chức năng trong các đường dẫn truyền tín hiệu. Có bằng chứng cho thấy Lyn được định vị tại màng tế bào; Lyn liên kết cả về cấu trúc và chức năng với nhiều loại phân tử thụ thể.
Fibroblasts (một loại tế bào tổng hợp ra chất ngoại bào và collagen có liên quan đến chữa lành vết thương) đã được biến đổi bởi virus polyoma có hoạt tính tyrosine cao hơn trong tế bào chất. Hơn nữa, hoạt động của tyrosine kinase đã được xác định là có liên quan đến sự biến đổi tế bào. Người ta cũng chứng minh rằng sự phosphoryl hóa một kháng nguyên trung gian T trên tyrosine cũng liên quan đến sự biến đổi tế bào tương tự như sự tăng trưởng hoặc sinh sản của tế bào.
Việc truyền năng lượng cơ học và tín hiệu điều tiết là vấn đề cơ bản trong sự tồn tại bình thường của một sinh vật sống. Protein tyrosine kinase đóng vai trò quan trọng trong nhiệm vụ này. Một tyrosine kinase protein có tên pp125 có khả năng ảnh hưởng tới sự kết dính tế bào (được chỉ thị bởi một chất hóa miễn dịch huỳnh quang của kinase nói trên). Kết dính các cấu trúc phân tử có chức năng trong việc truyền năng lượng cơ học và tín hiệu điều tiết. Trong cộng đồng khoa học, pp125 còn được gọi là FAK (tiêu điểm bám dính kinase), do sự hiện diện nói trên của nó trong sự kết dính của tế bào. Protein tyrosine kinase pp125 là một trong những phosphotyrosine chính chứa protein trong các tế bào nguyên bào sợi và tế bào hình que. Fibroblasts là một loại tế bào chịu trách nhiệm chữa lành vết thương và cấu trúc tế bào ở động vật. Trình tự và cấu trúc của pp125 cho thấy nó có thể là thành viên mới của họ protein tyrosine kinase. Protein tyrosine kinase này chiếm đến 70% so với một số protein tyrosine kinase khác, một con số không giống với các thành viên của một họ tyrosine kinase protein đã thành lập. Ngoài ra, trình tự axit amin cho thấy rằng nó có liên quan đến tế bào chất, nó nằm trong một nhóm lớn các tyrosine protein tyrosine kinase. Nó được phát hiện khi các kháng thể đơn dòng được đánh dấu để nhận ra nó. Kháng thể đơn dòng, từ tế bào phôi gà được biến đổi bởi pp60v-src, nhận ra bảy loại protein có chứa phosphotyrosine khác nhau. Một trong những kháng thể đơn dòng này có tên 2A7, nhận ra pp125, hỗ trợ cho ý tưởng rằng pp125 là một protein tyrosine kinase.
Sự tăng sinh tế bào, như được giải thích trong một số chi tiết ở trên, chịu ảnh hưởng của tyrosine kinase. Một Tyrosine kinase đã được quan sát thấy ở trong nhân là Lyn, đây là loại kinase đầu tiên được phát hiện trong nhân tế bào, là một phần của họ Src của tyrosine kinase, có thể chứa trong nhân của các tế bào kertinocytes khác nhau, được kích thích bằng calci. Người ta đã tìm thấy Lyn ở trong chất nhân, trong lớp vỏ hạt nhân và trong mạng lưới sợi xơ giữ ổn định cấu trúc DNA. Ngoài ra, nó dường như là điều kiện duy trì chu kỳ tế bào. Tuy nhiên, sự đóng góp của protein Lyn cho toàn bộ hoạt động tyrosine kinase trong chất nhân là chưa rõ; do Lyn chỉ được trích xuất một phần, nên không thể quản lý được phép đo chính xác hoạt động của nó. Theo Vegesna et al.(1996), Lyn polypeptide có liên quan đến hoạt động tyrosine kinase trong chất nhân.
Khi enzyme tyrosine kinase bị tác động bởi các yếu tố nào đó có thể gây ra những thay đổi lớn. Một trong những yếu tố đó là một phân tử được liên kết thuận nghịch bởi protein, được gọi là phối tử. Một số tyrosine kinase thụ thể, tuy nhiên không phải tất cả, không thực hiện hoạt động chức năng của protein-kinase cho đến khi chúng được kích hoạt bởi một trong những phối tử này. Các thụ thể tyrosine kinase được kích hoạt đã tái hoạt động trở lại trong thời gian ngắn và cuối cùng được chuyển đến lysosome, nơi hoạt động của chúng. Các phức hợp tín hiệu nội bộ có liên quan đến vai trò khác nhau trong các hệ thống tyrosine kinase thụ thể khác nhau. Ngoài ra, phối tử tham gia vào liên kết thuận nghịch, thuật ngữ mô tả các chất ức chế liên kết không cộng hóa trị. Trong mọi trường hợp, sự ràng buộc của phối tử với đối tác của nó là do các tác động mà nó có thể có đối với chức năng của nhiều protein. Thụ thể Tyrosine kinase được kích hoạt bằng ligand, thể hiện một thuộc tính duy nhất. Khi một thụ thể Tyrosine kinase được liên kết với phối tử của nó, nó có thể liên kết với tyrosine kinase cư trú trong cytosol của tế bào.
Ví dụ sự trưởng thành của hồng cầu
Một ví dụ về hệ thống kích hoạt này là điều hòa quá trình hình thành hồng cầu. Động vật có vú sở hữu hệ thống này, bắt đầu ở thận nơi tín hiệu biệt hóa được tạo ra. Tín hiệu biệt hóa, còn được gọi là cytokine, trong trường hợp này là erythropoietin (là cytokine điều hòa chính của sự tăng sinh và biệt hóa tế bào tạo hồng cầu). Hoạt động của Erythropoietin được bắt đầu khi các thụ thể cytokine tạo máu được kích hoạt. Trong điều hòa quá trình hình thành hồng cầu, erythropoietin là một protein chứa 165 axit amin có vai trò kích hoạt protein kinase JAK (Janus kinase). Kết quả của một số nghiên cứu mới hơn cũng chỉ ra rằng các thụ thể cytokine đã nói ở trên có cùng chức năng với các thành viên của họ JAK tyrosine kinase. Các thụ thể cytokine kích hoạt kinase JAK, dẫn đến sự phosphoryl hóa một số protein tín hiệu nằm trong màng tế bào. Điều này ảnh hưởng đến cả việc kích thích các thụ thể qua trung gian phối tử và kích hoạt đường dẫn tín hiệu nội bào. Quá trình này cũng chịu trách nhiệm trung gian sản xuất các tế bào máu. Trong trường hợp này, erythropoietin liên kết với thụ thể màng bào tương tương ứng. Dimer chịu trách nhiệm kích hoạt kinase JAK thông qua liên kết. Tyrosine nằm trong miền tế bào chất của thụ thể erythropoietin do đó bị phosphoryl hóa bởi protein kinase JAK hoạt hóa. Nhìn chung, đây cũng là cách một tyrosine kinase thụ thể có thể được kích hoạt bởi một phối tử để điều chỉnh sự hình thành hồng cầu.
Các ví dụ khác
Ảnh hưởng của tyrosine kinase đến các yếu tố liên quan đến insulin đã được xác định là một ví dụ nữa. Thụ thể insulin là các phân tử có chức năng truyền tín hiệu có vai trò điều chỉnh tác dụng của insulin. Nhiều enzyme thụ thể có cấu trúc và hoạt động tyrosine kinase của thụ thể. Các thụ thể insulin IRS2 và IRS3 đều có chức năng tăng cường khả năng truyền tín hiệu trong các con đường được bắt đầu bởi các tyrosine kinase của thụ thể. Các phân tử IRS1 được kích hoạt giúp tăng cường tín hiệu do insulin tạo ra.
Hệ thống thụ thể yếu tố tăng trưởng biểu bì cũng là một ví dụ khác. Trong trường hợp này, một số tín hiệu được tạo ra từ bề mặt tế bào, nhưng các tín hiệu khác dường như phát ra từ bên trong bào tương. Sự đa dạng của chức năng này có thể là một phương tiện để tạo ra các tín hiệu đặc trưng cho phối tử. Điều này ủng hộ quan niệm rằng sửa đổi protein sau khi dịch mã mRNA, có thể rất quan trọng đối với chức năng của tín hiệu thụ thể.
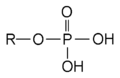
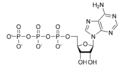
Tyrosin Phosphat ATP
Cấu trúc của Tyrosine kinase
Tất cả các protein tyrosine kinase có một số đặc điểm cấu trúc có thể được nhận ra là có một vị trí gắn với ATP, ba dư lượng được cho là có liên quan đến chức năng của nhóm phosphate thứ ba (thường được gọi là nhóm gamma-phosphate) của một phân tử ATP liên kết với enzyme và một vị trí xúc tác của enzyme đó là một axit amin. Hai chuỗi peptide cũng rất phổ biến trong các tyrosine kinase protein.
Có hơn 100 cấu trúc 3D của tyrosine kinase có sẵn tại Ngân hàng Dữ liệu Protein. Một ví dụ là PDB: 1IRK, cấu trúc tinh thể của miền tyrosine kinase của thụ thể insulin ở người.
Các họ Tyrosine kinase
Tyrosine kinase được chia thành hai họ chính:
- Các kinase liên kết với thụ thể xuyên màng (kinase thụ thể).
- Các kinase là những protein trong tế bào chất (kinase không thụ thể).
Hơn 90 protein tyrosine kinase (PTK) đã được tìm thấy trong bộ gen của con người. Chúng được chia thành hai lớp, tyrosine kinase thụ thể và không thụ thể.
Thụ thể tyrosine kinase
Đến năm 2004, 58 thụ thể tyrosine kinase (RTKs) đã được phát hiện, được chia thành 20 phân nhóm. Chúng đóng vai trò then chốt trong các hoạt động đa dạng của tế bào bào gồm tăng trưởng, biệt hóa, trao đổi chất, bám dính, vận động, chết tế bào. RTKs bao gồm một miền ngoại bào, có khả năng liên kết một phối tử cụ thể, miền xuyên màng và miền xúc tác nội bào, có khả năng liên kết và phosphoryl hóa các chất nền được chọn. Liên kết của một phối tử với khu vực ngoại bào gây ra một loạt các sắp xếp lại cấu trúc trong RTKs dẫn đến kích hoạt enzyme của nó. Cụ thể, sự di chuyển của một số phần của miền kinase cho phép truy cập vào adenosine triphosphate (ATP) và chất nền đến vị trí hoạt động. Điều này kích hoạt một loạt các sự kiện thông qua quá trình phosphoryl hóa các protein nội bào mà cuối cùng truyền ("tải nạp") tín hiệu ngoại bào đến nhân, gây ra những thay đổi trong biểu hiện gen. Nhiều RTKs có liên quan đến sự phát sinh ung thư, do đột biến gen hoặc dịch mã nhiễm sắc thể, hoặc đơn giản là do biểu hiện quá mức. Trong mọi trường hợp, kết quả là một kinase siêu hoạt động, tạo ra một kích thích tăng trưởng không phụ thuộc vào ligand, và sinh ra các tế bào ung thư.
Tyrosin kinase tế bào chất (không thụ thể)
Ở người, có 32 protein tyrosine kinase (EC 2.7.10.2).
Tyrosine kinase không thụ thể đầu tiên được xác định là protein gây ung thư v-Src. Hầu hết các tế bào động vật có chứa một hoặc nhiều thành viên của họ Src của tyrosine kinase. Một loại virus sarcoma gà đã được tìm thấy mang các phiên bản đột biến của gen Src tế bào bình thường. Gen v-src bị đột biến đã mất đi sự ức chế tích hợp bình thường của hoạt động enzyme, đặc trưng của gen SRC (c-src) của tế bào. Các thành viên gia đình SRC đã được tìm thấy có vai trò điều chỉnh nhiều quá trình truyền tin. Ví dụ, thụ thể kháng nguyên tế bào T dẫn đến tín hiệu nội bào bằng cách kích hoạt Lck và Fyn , hai protein có cấu trúc tương tự Src.
Ý nghĩa lâm sàng
Ức chế protein kinase
Ngày nay Tyrosine kinase là enzyme đặc biệt quan trọng vì ý nghĩa của chúng trong điều trị ung thư. Đột biến làm cho một số tyrosine kinase hoạt động được hình thành có liên quan đến một số bệnh ung thư. Imatinib (tên thương hiệu Gleevec và Glivec) là một loại thuốc có khả năng liên kết khe xúc tác của các tyrosine kinase này, ức chế hoạt động của nó.
Hoạt động Tyrosine kinase cũng tham gia đáng kể vào các sự kiện khác, đôi khi được coi là rất bất lợi. Ví dụ, hoạt động tăng cường của enzyme liên quan đến sự biến dạng chức năng của một số hệ thống, chẳng hạn như phân chia tế bào. Nhiều bệnh liên quan đến viêm cục bộ như xơ vữa động mạch và bệnh vảy nến, hoặc viêm hệ thống như nhiễm khuẩn huyết và sốc nhiễm khuẩn. Một số virus nhắm vào chức năng tyrosine kinase trong quá trình lây nhiễm. Virus polyoma ảnh hưởng đến hoạt động tyrosine kinase bên trong chất nhân. Nguyên bào sợi là các tế bào liên quan đến chữa lành vết thương và hình thành cấu trúc tế bào trong tế bào động vật có vú. Khi các tế bào này bị biến đổi bởi virus polyoma, hoạt động tyrosine mạnh hơn được quan sát thấy trong bào tương tế bào, cũng liên quan đến sự tăng sinh tế bào. Một loại virut khác nhắm vào tyrosine kinase là virus Rous sarcoma, một loại retrovirus gây sarcoma ở gà. Các tế bào bị nhiễm biểu hiện bị sửa đổi cấu trúc rõ ràng và quy định tăng trưởng tế bào là cực kỳ bất thường. Protein tyrosine kinase được mã hóa bởi virus Rous sarcoma gây biến đổi tế bào và được gọi là oncoprotein. Ngoài ra, tyrosine kinase đôi khi có thể hoạt động không chính xác theo cách dẫn đến ung thư phổi không phải tế bào nhỏ. Một loại ung thư phổ biến, ung thư phổi không phải tế bào nhỏ là nguyên nhân gây tử vong ở nhiều người hơn so với tổng số ung thư vú, đại trực tràng và tuyến tiền liệt cộng lại.
Nhiều nghiên cứu đã chỉ ra rằng sự phosphoryl hóa protein xảy ra trên dư lượng của tyrosine bởi tyrosine kinase protein liên quan đến màng tế bào trong các tế bào bình thường. Phosphoryl hóa đóng một vai trò quan trọng trong tín hiệu tế bào điều chỉnh số lượng và sự đa dạng của các yếu tố tăng trưởng. Điều này được chứng minh bằng việc quan sát thấy các tế bào bị ảnh hưởng bởi virus Rous sarcoma hiển thị các sửa đổi cấu trúc và thiếu hoàn toàn quy trình tăng trưởng tế bào bình thường. Các oncoprotein được mã hóa bởi virus Rous sarcoma (là các kinase protein tyrosine) là nguyên nhân của sự biến đổi tế bào này. Hoạt động phosphoryl hóa Tyrosine cũng tăng hoặc giảm kết hợp với những thay đổi trong thành phần tế bào và điều hòa tăng trưởng. Theo cách này, một sự biến đổi nhất định được thể hiện bởi các tế bào phụ thuộc vào vai trò mà tyrosine kinase thể hiện. Protein tyrosine kinase có vai trò chính trong việc kích hoạt tế bào lympho. Ngoài ra, chúng có chức năng làm trung gian các con đường truyền tin trong các loại tế bào như tuyến thượng thận, tiểu cầu và tế bào thần kinh.
Một tyrosine kinase có thể trở thành một enzyme không được kiểm soát trong một sinh vật do những ảnh hưởng đã được thảo luận, chẳng hạn như đột biến và nhiều hơn nữa. Hành vi này gây ra sự tàn phá; các quá trình thiết yếu trở nên vô tổ chức. Các hệ thống mà sinh vật dựa vào xảy ra sự cố, thường dẫn đến ung thư. Ngăn chặn điều này là mong muốn lớn của chúng ta. Nhiều nghiên cứu đã ghi nhận tác dụng đáng kể mà các chất ức chế enzyme tyrosine kinase protein hoạt động có trong các bệnh liên quan (Xem mục chất ức chế Tyrosine kinase).
Ung thư phổi không phải tế bào nhỏ
Phản ứng của các tế bào ung thư với chất ức chế tyrosine kinase được đánh giá trong một thử nghiệm lâm sàng. Trong trường hợp này, Gefitinib là chất ức chế tyrosine kinase. Chức năng tyrosine kinase không chính xác có thể dẫn đến ung thư phổi không phải tế bào nhỏ. Gefitinib là một chất ức chế tyrosine kinase nhắm vào thụ thể yếu tố tăng trưởng biểu mô, tạo ra kết quả thuận lợi ở bệnh nhân ung thư phổi không phải tế bào nhỏ. Một loại ung thư phổ biến, ung thư phổi không phải tế bào nhỏ là nguyên nhân gây tử vong ở nhiều người hơn là ung thư vú, đại trực tràng và tuyến tiền liệt cộng lại. Đây là động lực mạnh mẽ để thực hiện nghiên cứu về các chất ức chế tyrosine kinase là mục tiêu tiềm năng trong điều trị ung thư. Gefitinib, hoạt động như một chất ức chế tyrosine kinase của yếu tố tăng trưởng biểu mô, cải thiện các triệu chứng liên quan đến ung thư phổi không phải tế bào nhỏ và làm thu nhỏ khối u. Đây là một ví dụ về hiệu quả của chất ức chế như vậy. Quá trình ức chế cho thấy ung thư duy trì như thế nào. Đột biến trong thụ thể yếu tố tăng trưởng biểu bì kích hoạt các con đường truyền tín hiệu thúc đẩy sự sống của tế bào. Các tế bào ung thư phổi không phải tế bào nhỏ trở nên phụ thuộc vào các tín hiệu sinh tồn này. Sự ức chế các tín hiệu sinh tồn của Gefitinib có thể là một cơ chế giúp giải thích hiệu quả của nó như là một loại thuốc để điều trị ung thư phổi không phải tế bào nhỏ.
Gefitinib được dung nạp tốt ở người và được sử dụng trong điều trị làm tỷ lệ cải thiện triệu chứng là 43% (với độ tin cậy 95% trong khoảng 33% 43% 53%) cho những bệnh nhân nhận được 250mg Gefitinib và 35% (với độ tin cậy 95% Khoảng cách 26% 45%) cho những người nhận được 500mg. Trong thử nghiệm, thụ thể yếu tố tăng trưởng biểu mô cho thấy phản ứng nhanh với chất ức chế, được chứng minh bằng sự cải thiện các triệu chứng ung thư. Trong mỗi nhóm, sự cải thiện đã được ghi nhận sau một tuần điều trị bằng thuốc ức chế thụ thể yếu tố tăng trưởng tyrosine kinase. Uống Gefitinib mỗi ngày một lần tạo ra sự cải thiện triệu chứng nhanh chóng và thu nhỏ khối u ở bệnh nhân ung thư phổi không phải tế bào nhỏ. Trong lĩnh vực nghiên cứu y học, đây là một ví dụ đặc biệt quan trọng về việc sử dụng chất ức chế để điều trị ung thư liên quan đến tyrosine kinase. Hóa trị, phẫu thuật và xạ trị là những lựa chọn chính duy nhất có sẵn trước những khám phá được thực hiện trong thử nghiệm này. Tác dụng phụ của điều trị bằng đường uống Gefitinib mỗi ngày một lần được coi là đáng kể. Tiêu chảy đã được báo cáo ở 57% bệnh nhân trong nhóm uống 250mg và 75% trong nhóm uống 500mg. Một bệnh nhân bị tiêu chảy nặng hơn ở nhóm 2, có tới sáu lần đi tiêu chỉ trong một ngày. Ngoài ra, một trường hợp tử vong xảy ra có thể do điều trị bằng thuốc ức chế thụ thể yếu tố tăng trưởng tyrosine kinase; tuy nhiên, mối liên quan không được rõ ràng. Ngoài ra, độc tính trên da cũng được quan sát thấy ở 62% bệnh nhân trong nhóm uống 250mg. Tuy nhiên, tác dụng phụ của Gefitinib nói chung là nhẹ, có thể kiểm soát được, không tích lũy và có thể đảo ngược. Thật không may, ngừng dùng thuốc ức chế có thể là yếu tố duy nhất làm xuất hiện trở lại các triệu chứng bất lợi. Gefitinib vẫn đại diện cho một phương pháp điều trị hợp lý và an toàn so với các phương pháp điều trị ung thư khác.
Hơn nữa, thụ thể yếu tố tăng trưởng biểu mô đóng một vai trò quan trọng trong nguyên nhân gây ra khối u , đó là sản sinh ra một khối u mới. Đến năm 2010, hai kháng thể đơn dòng và một chất ức chế tyrosine kinase phân tử nhỏ khác gọi là Erlotinib cũng đã được phát triển để điều trị ung thư.
Ngày 12 tháng 7 năm 2013, FDA đã phê duyệt afatinib cho điều trị bệnh nhân ung thư phổi không phải tế bào nhỏ di căn (NSCLC), khối u có đột biến yếu tố tăng trưởng biểu mô (EGFR).
Bệnh bạch cầu dòng tủy mạn
BCR-ABL là một tyrosine kinase được kích hoạt có liên quan đến bệnh bạch cầu dòng tủy mạn tính. Nó được hình thành từ một gen tổng hợp khi các mảnh nhiễm sắc thể 9 và 22 vỡ ra và trao đổi. Gen ABL trên nhiễm sắc thể 9 tách ra và kết hợp với gen BCR ở nhiễm sắc thể 22 để tạo thành gen hợp nhất BCR-ABL gọi là nhiễm sắc thể Philadelphia (Nhiễm sắc thể Philadelphia là nhiễm sắc thể số 22 ở người bị đột biến thêm đoạn từ nhiễm sắc thể số 9 chuyển vào, được phát hiện lần đầu tiên vào năm 1959 ở người bị ung thư bạch cầu tại Philadelphia). Gen đột biến BCR-ABL sản sinh quá nhiều một loại protein có chức năng enzym là BCR-ABL Tyrosine kinase nên dẫn đến bệnh. Do đó, ức chế nó cải thiện các triệu chứng ung thư. Trong số các chất ức chế hiện có để điều trị bệnh bạch cầu tủy mạn là Imanitib, Dasanitib, Nilotinib, Bosutinib, và Ponatinib.
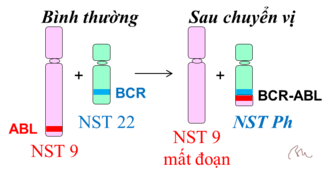
Hình 1. Gen ABL từ nhiễm sắc thể 9 chuyển sang gắn với gen BCR của nhiễm sắc thể 22 thành gen BCR-ABL. Nnhiễm sắc thể 22 biến dị được gọi là nhiễm sắc thể Philadelphia (Ph).
Các khối u mô đệm đường tiêu hóa
Các khối u mô đệm đường tiêu hóa (GIST) được biết là chịu tác dụng điều trị hóa trị ung thư và không đáp ứng với bất kỳ loại trị liệu nào khác (năm 2001) trong các trường hợp tiến triển. Tuy nhiên, thuốc ức chế tyrosine kinase STI571 (imatinib) có hiệu quả trong điều trị bệnh nhân bị khối u mô đệm đường tiêu hóa di căn. Các khối u mô đệm đường tiêu hóa bao gồm một cụm các khối u trung mô được hình thành từ tiền chất đến các tế bào tạo nên mô liên kết trong đường tiêu hóa. Hầu hết các khối u này được tìm thấy ở dạ dày, mặc dù chúng cũng có thể ở ruột non hoặc những nơi khác trong đường ruột. Các tế bào của các khối u này có một thụ thể yếu tố tăng trưởng liên quan đến hoạt động tyrosine kinase. Thụ thể yếu tố tăng trưởng này được gọi là c-kit và được sản xuất bởi một proto-oncogene (c-kit). Đột biến của c-kit gây ra hoạt động bất thường của tyrosine kinase, dẫn đến khối u ung thư mô đệm đường tiêu hóa. Kết quả của đột biến c-kit dẫn đến hoạt động tyrosine kinase không hạn chế và tăng sinh tế bào, phosphoryl hóa không được kiểm soát của c-kit và phá vỡ một số con đường truyền tin. Điều trị bằng imatinib có thể ức chế các cơ chế truyền tín hiệu tế bào không bình thường trong các khối u mô đệm đường tiêu hóa. Điều này dẫn đến hiệu quả đáng kể ở bệnh nhân và kiểm soát được bệnh kéo dài. Đến năm 2001, người ta không còn nghi ngờ hiệu quả của chất ức chế này và được sử dụng an toàn ở người. Theo cách tương tự, chất ức chế protein tyrosine kinase STI571 đã làm giảm đáng kể kích thước của khối u; Các khối u đã giảm khoảng 65% kích thước trong 4 tháng thử nghiệm và tiếp tục giảm dần. Các tổn thương mới đã không xuất hiện, và một số di căn gan đã giảm hoàn toàn giống như không tồn tại. Bệnh nhân duy nhất trong nghiên cứu vẫn khỏe mạnh sau khi điều trị. Không có phương pháp điều trị hiệu quả đối với các khối u mô đệm đường tiêu hóa tiến triển, nhưng STI571 đại diện cho một phương pháp điều trị hiệu quả trong ung thư giai đoạn đầu liên quan đến c-kit hoạt động, bằng cách ức chế hoạt động tyrosine kinase bất thường.
Các chất ức chế Tyrosine kinase
Để giảm hoạt động của enzyme, các phân tử ức chế liên kết với enzyme. Giảm hoạt động của enzyme có thể vô hiệu hóa mầm bệnh hoặc điều chỉnh các hệ thống chức năng không chính xác; như vậy, nhiều chất ức chế enzyme được phát triển để sử dụng làm thuốc.
Các khối u mô đệm đường tiêu hóa (GIST) và Imatinib
Các khối u mô đệm đường tiêu hóa (GIST) là các khối u trung mô xảy ra ở đường tiêu hóa. Có rất ít lựa chọn điều trị cho các khối u này. Tuy nhiên, Imatinib như một chất ức chế enzyme bị trục trặc, có thể có hiệu quả.
Bệnh bạch cầu tủy mạn và nilotinib
Nếu imatinib không hoạt động, bệnh nhân mắc bệnh bạch cầu tủy mạn tiến triển có thể sử dụng nilotinib, dasatinib, bosutinib, ponatinib hoặc một chất ức chế khác đối với enzyme bị trục trặc gây ra bệnh bạch cầu. Chất ức chế này là chất ức chế tyrosine kinase BCR-ABL có tính chọn lọc cao.
Những chất khác
Sunitinib là một chất ức chế tyrosine kinase đường uống tác động lên thụ thể yếu tố tăng trưởng nội mô mạch máu (VEGFR), thụ thể yếu tố tăng trưởng có nguồn gốc tiểu cầu (PDGFR), thụ thể yếu tố tế bào gốc và thụ thể tác nhân kích thích -1 (CFS-1R).
Gefinitib và erlotinib ức chế miền tyrosine kinase của thụ thể yếu tố tăng trưởng biểu mô (EGFR), được sử dụng để điều trị ung thư phổi và tụy, nơi thường có biểu hiện hoạt động quá mức của tyrosine kinase bề mặt các tế bào này.
Thuốc ức chế Kinase cũng có thể đáp ứng qua trung gian. Paracrine đáp ứng qua trung gian các chất ức chế thụ thể yếu tố tăng trưởng biểu mô.
Mời đọc thêm: Họ enzym Tyrosine Kinase và liệu pháp nhắm chúng đích trên: http://hahoangkiem.com/thuoc/ho-enzym-tyrosine-kinase-va-lieu-phap-nham-chung-dich-3677.html?fbclid=IwAR0o-NPINYtUD_YhbtdXhOUARcUgZWkThcztCqp5MsUa7KZ4xc6nZ1ffat8
Tài liệu tham khảo:
- Hanks SK, Quinn AM, Hunter T (July 1988). "The protein kinase family: conserved features and deduced phylogeny of the catalytic domains". Science. 241 (4861): 42–52. doi:10.1126/science.3291115. PMID 3291115.
- Cox, Michael; Nelson, David R. (2008). Lehninger: Principles of Biochemistry (fifth ed.). W H Freeman & Co. ISBN 978-1-4292-2416-1.
- Radha V, Nambirajan S, Swarup G (March 1996). "Association of Lyn tyrosine kinase with the nuclear matrix and cell-cycle-dependent changes in matrix-associated tyrosine kinase activity". European Journal of Biochemistry. 236 (2): 352–9. doi:10.1111/j.1432-1033.1996.00352.x. PMID 8612602.
- Ruetten H, Thiemermann C (September 1997). "Effects of tyrphostins and genistein on the circulatory failure and organ dysfunction caused by endotoxin in the rat: a possible role for protein tyrosine kinase". British Journal of Pharmacology. 122 (1): 59–70. doi:10.1038/sj.bjp.0701345. PMC 1564904. PMID 9298529.
- Schaller MD, Borgman CA, Cobb BS, Vines RR, Reynolds AB, Parsons JT (June 1992). "pp125FAK a structurally distinctive protein-tyrosine kinase associated with focal adhesions". Proceedings of the National Academy of Sciences of the United States of America. 89 (11): 5192–6. doi:10.1073/pnas.89.11.5192. PMC 49256. PMID 1594631.
- Dengjel J, Kratchmarova I, Blagoev B (October 2009). "Receptor tyrosine kinase signaling: a view from quantitative proteomics". Molecular BioSystems. 5 (10): 1112–21. doi:10.1039/b909534a. PMID 19756300.
- Wiley HS, Burke PM (January 2001). "Regulation of receptor tyrosine kinase signaling by endocytic trafficking". Traffic. 2 (1): 12–8. doi:10.1034/j.1600-0854.2001.020103.x. PMID 11208164.
- Rinker S, Ke Y, Liu Y, Chhabra R, Yan H (July 2008). "Self-assembled DNA nanostructures for distance-dependent multivalent ligand-protein binding". Nature Nanotechnology. 3 (7): 418–22. doi:10.1038/nnano.2008.164. PMC 2556356. PMID 18654566.
- Jump up to:a b c Silvennoinen O, Saharinen P, Paukku K, Takaluoma K, Kovanen P (July 1997). "Cytokine receptor signal transduction through Jak tyrosine kinases and Stat transcription factors". APMIS. 105 (7): 497–509. doi:10.1111/j.1699-0463.1997.tb05047.x. PMID 9269296.
- Bhise SB, Nalawade AD, Wadhawa H (December 2004). "Role of protein tyrosine kinase inhibitors in cancer therapeutics". Indian Journal of Biochemistry & Biophysics. 41 (6): 273–80. PMID 22900354.
- Gunby RH, Sala E, Tartari CJ, Puttini M, Gambacorti-Passerini C, Mologni L (November 2007). "Oncogenic fusion tyrosine kinases as molecular targets for anti-cancer therapy". Anti-Cancer Agents in Medicinal Chemistry. 7 (6): 594–611. doi:10.2174/187152007784111340. PMID 18045055.
- Weinberg, Robert A. (2007). The Biology Of Cancer. New York: Garland Science, Taylor & Francis Group, LLC. pp. 757–759. ISBN 978-0-8153-4076-8.
- Kris MG, Natale RB, Herbst RS, Lynch TJ, Prager D, Belani CP, Schiller JH, Kelly K, Spiridonidis H, Sandler A, Albain KS, Cella D, Wolf MK, Averbuch SD, Ochs JJ, Kay AC (October 2003). "Efficacy of gefitinib, an inhibitor of the epidermal growth factor receptor tyrosine kinase, in symptomatic patients with non-small cell lung cancer: a randomized trial". JAMA. 290 (16): 2149–58. doi:10.1001/jama.290.16.2149. PMID 14570950.
- Jump up to:a b Sordella R, Bell DW, Haber DA, Settleman J (August 2004). "Gefitinib-sensitizing EGFR mutations in lung cancer activate anti-apoptotic pathways". Science. 305 (5687): 1163–7. doi:10.1126/science.1101637. PMID 15284455.
- Jump up to:a b Okamoto I (January 2010). "Epidermal growth factor receptor in relation to tumor development: EGFR-targeted anticancer therapy". The FEBS Journal. 277 (2): 309–15. doi:10.1111/j.1742-4658.2009.07449.x. PMID 19922468.
- Druker BJ, Talpaz M, Resta DJ, Peng B, Buchdunger E, Ford JM, Lydon NB, Kantarjian H, Capdeville R, Ohno-Jones S, Sawyers CL (April 2001). "Efficacy and safety of a specific inhibitor of the BCR-ABL tyrosine kinase in chronic myeloid leukemia". The New England Journal of Medicine. 344 (14): 1031–7. doi:10.1056/NEJM200104053441401. PMID 11287972.
- Jump up to:a b c d e f Joensuu H, Roberts PJ, Sarlomo-Rikala M, Andersson LC, Tervahartiala P, Tuveson D, Silberman S, Capdeville R, Dimitrijevic S, Druker B, Demetri GD (April 2001). "Effect of the tyrosine kinase inhibitor STI571 in a patient with a metastatic gastrointestinal stromal tumor". The New England Journal of Medicine. 344 (14): 1052–6. doi:10.1056/NEJM200104053441404. PMID 11287975.
- Jump up to:a b c Blanke CD, Demetri GD, von Mehren M, Heinrich MC, Eisenberg B, Fletcher JA, Corless CL, Fletcher CD, Roberts PJ, Heinz D, Wehre E, Nikolova Z, Joensuu H (February 2008). "Long-term results from a randomized phase II trial of standard- versus higher-dose imatinib mesylate for patients with unresectable or metastatic gastrointestinal stromal tumors expressing KIT". Journal of Clinical Oncology. 26 (4): 620–5. CiteSeerX 10.1.1.690.6356. doi:10.1200/JCO.2007.13.4403. PMID 18235121.
- Jump up to:a b le Coutre P, Ottmann OG, Giles F, Kim DW, Cortes J, Gattermann N, Apperley JF, Larson RA, Abruzzese E, O'Brien SG, Kuliczkowski K, Hochhaus A, Mahon FX, Saglio G, Gobbi M, Kwong YL, Baccarani M, Hughes T, Martinelli G, Radich JP, Zheng M, Shou Y, Kantarjian H (February 2008). "Nilotinib (formerly AMN107), a highly selective BCR-ABL tyrosine kinase inhibitor, is active in patients with imatinib-resistant or -intolerant accelerated-phase chronic myelogenous leukemia". Blood. 111 (4): 1834–9. doi:10.1182/blood-2007-04-083196. PMID 18048643.
- Kuwai T, Nakamura T, Sasaki T, Kim SJ, Fan D, Villares GJ, Zigler M, Wang H, Bar-Eli M, Kerbel RS, Fidler IJ (May 2008). "Phosphorylated epidermal growth factor receptor on tumor-associated endothelial cells is a primary target for therapy with tyrosine kinase inhibitors". Neoplasia. 10 (5): 489–500. doi:10.1593/neo.08200. PMC 2373870. PMID 18472966.