ĐIỀU TRỊ THIẾU MÁU Ở BỆNH NHÂN SUY THẬN MẠN
PGS.TS. Hà Hoàng Kiệm, BV 103
(Trích trong THẬN HỌC LÂM SÀNG. NXB YH. 2010. của tác giả Hà Hoàng Kiệm)
1. Sinh lý của quá trình tạo hồng cầu
1.1. Sự trưởng thành của dòng hồng cầu
Nguyên bào máu là tế bào gốc tạo máu trong tủy xương, bình thường có khoảng 30+-5 ml/kg tủy ở đàn ông, và 25+-5 ml/kg tủy ở đàn bà. Dưới tác dụng của interleukin-I (IL-I), nguyên bào máu được biệt hóa thành các dòng tế bào máu khác nhau, như nguyên bào lympho, nguyên hồng cầu, nguyên tủy bào, nguyên bào nhân khổng lồ. Nguyên hồng cầu là tế bào đầu tiên của dòng hồng cầu. Dưới tác dụng của interleukin-III (IL-III) và GM-CSF (granulocyte macrophase-colony stimulating factor), nguyên hồng cầu được biệt hóa thành BFU-E (burst forming unite-erythroid). Sau đó có thêm vai trò của erythropoietin (EPO), BFU-E được biệt hóa thành CFU-E (colony forming unite - erythroid). Dưới tác dụng của EPO, CFU-E được biệt hóa thành tiền hồng cầu non. CFU-E nhậy cảm với EPO hơn BFU-E, vì người ta thấy nó đòi hỏi nồng độ EPO thấp hơn khi nuôi cấy. Tham gia cùng với EPO để biệt hóa BFU-E thành CFU-E còn có insulin hoặc yếu tố phát triển I giống insulin.
1.2. Vai trò của erythropoietin trong quá trình biệt hóa dòng hồng cầu
Hình 21.2. Quá trình biệt hóa dòng hồng cầu
IL-I: Interleukin-I; IL-III: Interleukin-III
GM-CSF: Granulocyte Macrophase-Colony Stimulating Factor
CFU: Colony Forming Unite
CFU-E: Colony Forming Unite-Erythroid
BFU-E: Burst Forming Unite-Erythroid
Erythropoietin (EPO) tác động thông qua các receptor đặc hiệu có trên màng tế bào nguyên hồng cầu, EPO có vai trò điều chỉnh pha phân bào hơn là kích thích các tế bào nghỉ đi vào vòng phân chia. Ở chuột cống, người ta phát hiện có hai lớp receptors, lớp có ái lực cao và lớp có ái lực thấp, với 600-700 receptors/một tế bào. Ở chuột nhắt trắng, nguyên bào máu có một lớp receptors, với mật độ khoảng 550 receptors/một tế bào (Krantz và cs, 1988). Số lượng receptors của EPO là thấp so với số lượng receptors của các yếu tố phát triển. Số lượng receptors của GM-CSF và của G-CSF cũng thấp (Krantz và cs, 1987). Hai yếu tố này cùng với EPO làm tế bào dòng hồng cầu trưởng thành đến giai đoạn hồng cầu non. Khi EPO tiếp xúc với receptor thì phức hợp EPO với receptor được tạo thành nhanh chóng, nhưng ảnh hưởng của EPO bên trong tế bào như thế nào chưa được biết. Người ta thấy EPO gây tăng calci nội bào và tăng sử dụng glucose trong vòng một giờ, sao chép chuỗi globin trong 6 giờ, và tổng hợp hem trong 12 giờ (Koury và cs 1987; Krantz và cs 1988). Biệt hóa dòng hồng cầu đến tiền hồng cầu non, cùng với EPO còn có IL-III. Từ giai đoạn CFU-E đến hồng cầu trưởng thành mất 7 ngày.
Các yếu tố tăng trưởng như IL-III và GM-CSF được tạo ra từ các tế bào đệm của tủy xương, các macrophase, các tế bào mỡ, tế bào lưới, tế bào nội mô và tế bào xơ trong tủy xương. Các yếu tố này cùng với EPO biệt hóa dòng hồng cầu.
1.3. Các yếu tố cần thiết để tạo hồng cầu
Để sản sinh 17 ml hồng cầu mỗi ngày từ tủy xương, đòi hỏi một số yếu tố, như sắt, acid folic, vitamin B12, vitamin B6, vitamin C, và nhiều yếu tố vi lượng. Trong các yếu tố trên, sắt là nguyên tố quan trọng nhất đối với cả thiếu máu do suy thận và thiếu máu không do suy thận.
1.3.1. Hấp thu và chuyển hóa sắt
Phân tử hem gồm 4 chuỗi globin và có thể mang 4 nguyên tử oxy. Hầu hết lượng sắt có trong tuần hoàn được dùng để tổng hợp hemoglobin. Sắt được vận chuyển trong huyết thanh dưới dạng transferin. Transferin được tổng hợp ở gan và lượng transferin có liên quan với lượng sắt dự trữ.
Lượng sắt bị mất hàng ngày trung bình khoảng 1 mg ở đàn ông, và 2 mg ở đàn bà. Trong thực phẩm ăn hàng ngày có khoảng 14 mg sắt, trong điều kiện bình thường, có 5-10% lượng sắt này được hấp thu. Hấp thu sắt từ ruột tùy thuộc vào nhu cầu sắt của cơ thể. Lượng sắt có sẵn trong máu là yếu tố kích thích gan tổng hợp ferritin, ferritin là một protein có khả năng tích trữ sắt. Ở người bình thường, nồng độ ferritin trong huyết thanh có liên quan chặt với lượng sắt dự trữ. Ở phụ nữ, lượng sắt dự trữ có giá trị trung bình 30 mcg/l, thấp hơn so với đàn ông (100 mcg/l), tương ứng với tổng lượng sắt có trong cơ thể là 300 mg và 1000mg. Đo sự thay đổi sắt trong cơ thể được dùng để đánh giá giá trị hồng cầu, sự biến mất của transferin gắn Fe59 ở huyết thanh, được dùng để ước lượng sự luân chuyển sắt trong huyết tương, giúp cho việc tính toán sự luân chuyển sắt của hồng cầu. Ở người bình thường, t1/2 biến mất của transferin vận chuyển một sắt phóng xạ (Fe59) là 95+-35 phút, hồng cầu sử dụng trong hai tuần là 85+-5%, luân chuyển sắt trong huyết tương là 0,71-0,17 mg/dl.
1.3.2. Vitamin B12 (cobalamin)
Trong cơ thể vitamin B12 tạo thành các enzym hoạt động là methylcobalamin và 5-deoxyadenosylcobalamin, rất cần thiết cho tế bào sao chép và tăng trưởng, là yếu tố cần thiết trong quá trình tạo hồng cầu. Thiếu vitamin B12 gây thiếu máu nguyên hồng cầu khổng lồ.
1.3.3. Acid folic
Trong cơ thể acid folic được khử thành tetrahydrofolat, là một coenzym của nhiều quá trình chuyển hóa, trong đó có tổng hợp các nucleotid có nhân purin hoặc pyrimidin, do vậy ảnh hưởng đến tổng hợp DNA. Acid folic là yếu tố không thể thiếu trong tổng hợp nucleoprotein và tạo hồng cầu bình thường. Thiếu acid folic gây thiếu máu nguyên hồng cầu khổng lồ giống như thiếu vitamin B12.
1.3.4. Vitamin B6
Trong tự nhiên, vitamin B6 tồn tại dưới 3 dạng là pyridoxal, pyridoxin, pyridoxamin. Ở trong cơ thể, vitamin B6 được chuyển thành pyridoxal phosphat và một phần trở thành pyridoxamin phosphat. Chúng là các enzym tham gia vào chuyển hóa protein, glucid và lipid, và cần thiết cho quá trình tạo hồng cầu.
2. Erythropoietin
2.1. Vị trí sản sinh erythropoietin
1906 hai tác giả Carnot và Deflandre lần đầu tiên nêu lên có một yếu tố thể dịch trong huyết thanh có tác dụng kích thích sản sinh hồng cầu, được gọi là erythropoietin (EPO). Nhưng cho đến hơn 70 năm sau, người ta vẫn chưa biết gì thêm về EPO, nơi sản sinh EPO vẫn trong vòng bí mật. Trong thời gian này có ba giả thuyết được đưa ra để giải thích nguồn gốc của EPO. Thứ nhất, có một enzym trong huyết tương tác động lên một phân tử được sản sinh từ thận để tạo thành erythropoietin. Thứ hai, có một enzym từ thận tác động lên một yếu tố ban đầu có ở huyết tương để tạo thành erythropoietin. Thứ ba, erythropoietin được tổng hợp trực tiếp từ gen. Khoảng những năm 1980, người ta biết được cấu trúc phân tử của EPO, sau đó người ta phát hiện được mRNA của EPO (Jacobson và cs 1985; Lin và cs 1985) và xác định được các tế bào có chứa mRNA của EPO (Bondurant và Koury 1986; Beru và cs 1986). Từ đó người ta biết rõ ràng là EPO được tổng hợp trực tiếp từ gen, nơi tổng hợp EPO là thận và gan. Ở người và các động vật có vú lớn, thận sản xuất 90% EPO còn gan sản xuất 10% EPO (Jacobson và cs 1987).
Trước đây, việc xác định chắc chắn loại tế bào nào sản sinh EPO là rất khó khăn, vì không tìm thấy EPO tồn tại trong mô bằng phương pháp miễn dịch phóng xạ. Hiện nay nhìn lại, người ta thấy là do EPO sau khi tổng hợp được giải phóng luôn vào máu mà không tích trữ trong tế bào, nên người ta không tìm thấy dấu vết của EPO trong các tế bào sản sinh ra nó. Về sau người ta đã phát hiện mRNA của EPO có trong tế bào bằng cách lai ghép trong ống nghiệm. Không phải như người ta vẫn trông chờ ở tế bào cầu thận hay tế bào ống thận mà là các tế bào quanh ống thận đã sản sinh ra EPO (Koury và cs 1988; Lacombe và cs 1988), đó là các tế bào nội mô mao mạch bao quanh ống thận và tế bào xơ non trong mô kẽ thận và được gọi chung là các tế bào quanh ống thận. Gần đây Maxwell và cs (1988) còn báo cáo tìm thấy mRNA của EPO trong tế bào ống thận.
Mặc dù cho đến nay người ta chưa biết rõ cơ chế đáp ứng của các tế bào sản sinh ra EPO, nhưng có một số thông tin về điều chỉnh bài tiết EPO đã được biết. EPO được tổng hợp trực tiếp từ gen tổng hợp EPO, sau khi được tổng hợp EPO không được tích lũy trong tế bào mà được giải phóng ngay vào máu. Thời gian đòi hỏi để khởi động gen EPO khoảng 15 phút (Kurtz và cs 1988) và tăng số lượng mRNA của EPO ở thận khoảng 1 giờ sau khi có giảm oxy máu (Schuster và cs 1988), và cần thêm 30 phút để tổng hợp và giải phóng EPO.
Gen tổng hợp EPO gồm 5 exons và 4 introns, nằm ở vị trí trên của nhánh dài nhiễm sắc thể số 7 (Law và cs 1986). EPO người là một protein glycosylat có 165 amino acid. Trọng lượng phân tử của EPO phần không có glucose là 18400 Da, và có glucose là 34000Da. Phân tử EPO có ba vị trí gắn với N-glycosylation, một vị trí là O-glycosylation và hai vị trí liên kết disulphide (Lai và cs 1986). Người ta không tìm thấy một đồng phân nào giữa EPO và bất kỳ một protein nào khác. EPO của người và khỉ có 92% đồng hình, trong khi EPO của người và chuột cống có 82% đồng hình. Mặc dù dạng không có glycosylat của hormon vẫn có tác dụng sinh lý trên invitro, nhưng glycosylation vẫn đòi hỏi để làm chậm quá trình thanh thải EPO ở gan (Goto và cs 1988).
Cấu trúc phân tử Erythromycin
2.2. Các yếu tố ảnh hưởng đến tổng hợp erythropoietin
Hiện nay chưa có thông tin chi tiết về quá trình điều chỉnh tổng hợp EPO ở mức tế bào. Nồng độ EPO trong tuần hoàn phản ánh tốc độ tổng hợp EPO. Nồng độ EPO trong huyết thanh ở người bình thường là 10-25 mIU/ml, tương ứng với 100-250 pg/ml, hoặc 3-8 pmol/ml. Nửa đời sống trong huyết thanh của EPO là 5-9 giờ. Nghiên cứu dược động học của EPO, người ta xác định được rằng sản sinh EPO nội sinh với số lượng từ 2-4 mIU/kg/24 giờ.
Sản sinh EPO có thể giảm hoặc tăng dưới điều kiện thay đổi của oxy mô. Thiếu máu gây ra do mất máu hoặc giảm sản sinh hồng cầu là yếu tố kích thích mạnh nhất làm tăng nồng độ EPO huyết thanh. Thực nghiệm cho thở oxid carbon (CO) gây ra giảm khả năng vận chuyển oxy của máu, cũng gây ra tăng mạnh nồng độ EPO huyết thanh. Kích thích quan trọng khác làm tăng nồng độ EPO huyết thanh là phân áp oxy máu động mạch giảm, gặp trong bệnh tâm phế mạn hoặc do giảm phân áp oxy trong khí thở. Trái lại, trong các bệnh gây tăng số lượng hồng cầu, như bệnh thiếu máu đa hồng cầu, thường thấy nồng độ EPO trong huyết thanh ở mức bình thường thấp.
Thêm vào sự thay đổi của phân áp oxy máu động mạch, một số tác nhân chuyển hóa cũng ảnh hưởng tới sản sinh EPO. Thực nghiệm trên động vật cắt tuyến yên, hoặc để đói ăn, cũng thấy tăng nồng độ EPO trong huyết thanh. Kích thích chuyển hóa bằng uống hormon tuyến giáp làm tăng nồng độ EPO trong huyết thanh.
Có thể tóm tắt kết quả các quan sát lâm sàng và thực nghiệm như sau: tình trạng giảm cung cấp oxy hoặc nhu cầu đòi hỏi cung cấp oxy tăng, thường thấy tăng nồng độ EPO trong huyết thanh. Trái lại, trong điều kiện tăng cung cấp oxy hoặc giảm nhu cầu oxy, thường thấy giảm nồng độ EPO trong huyết thanh.
2.3. Vị trí nhạy cảm oxy trong điều chỉnh tổng hợp erythropoietin
Người ta chưa rõ vị trí nhậy cảm oxy kích thích tổng hợp EPO được định vị ở thận hay còn ở cơ quan nào khác, nhưng dường như phần tử nhạy cảm oxy có vai trò như một receptor hóa học kinh điển. Thực nghiệm làm giảm chọn lọc dòng máu thận, thấy tăng tổng hợp EPO. Ở thận cô lập, sau khi cho phân áp oxy dịch truyền vào thận thấp, thấy tăng giải phóng EPO. Như vậy vị trí nhạy cảm oxy để điều chỉnh tổng hợp EPO phải khu trú ở bản thân thận.
Khu vực nào của thận nhạy cảm với sự thay đổi oxy chưa được biết, nhưng vị trí nhạy cảm oxy hẳn là có liên quan với cấu trúc đòi hỏi phân áp oxy cao. Tiêu thụ oxy của thận chủ yếu do tốc độ tái hấp thu natri, do đó nếu ức chế tái hấp thu natri ở vị trí nào đó có thể chỉ ra vị trí nhạy cảm oxy. Ở động vật thực nghiệm, người ta ức chế tái hấp thu natri ở quai Henle bằng furosemid, ức chế tái hấp thu natri ở ống lượn xa bằng hydrochlothiazid, và ở ống góp bằng amilorid, không thấy giảm sản sinh EPO do thừa oxy. Khi sử dụng acetazolamid để ức chế tái hấp thu bicarbonat natri ở ống lượn gần, có dấu hiệu cho thấy giảm tổng hợp EPO. Dấu hiệu này gợi ý, tiêu thụ oxy ở ống lượn gần có liên quan với quá trình nhạy cảm oxy.
Cho đến nay người ta chưa biết, liệu bản thân tế bào sản sinh ra EPO có nhạy cảm với sự thay đổi phân áp oxy hay không. Nếu đây là một trường hợp thì chức năng của các tế bào ống lượn gần có thể là chức năng điều chỉnh sự thay đổi phân áp oxy. Bởi vì sự tiêu thụ oxy của tế bào ống lượn gần tăng hay giảm, sẽ làm thay đổi phân áp oxy của máu mao mạch bao quanh ống thận, và ảnh hưởng tới các tế bào sản sinh EPO. Nếu bản thân các tế bào sản sinh EPO không nhạy cảm với sự thay đổi của phân áp oxy, thì các tế bào ống lượn gần đáp ứng với dấu hiệu thiếu oxy đã khởi phát sự sản sinh EPO ở các tế bào liền kề với nó. Để phân biệt hai khả năng này, đòi hỏi phải nuôi cấy các tế bào sản sinh EPO biệt lập, nhưng mọi cố gắng phân lập các týp tế bào sản sinh EPO cho đến nay chưa thành công.
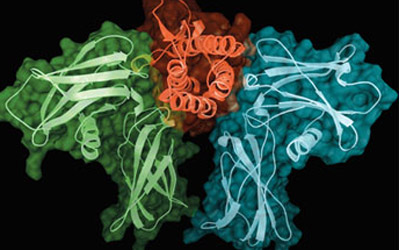
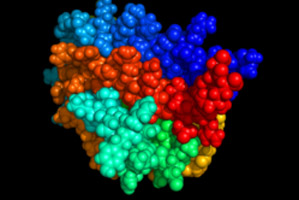
Mô hình cấu trúc không gian của phân tử EPO
3. Bệnh sinh của thiếu máu trong suy thận mạn
3.1. Đặc điểm của thiếu máu ở bệnh nhân suy thận mạn
Trên tiêu bản máu ngoại vi của người suy thận mạn, thường thấy thiếu máu đẳng sắc, hình thái hồng cầu bình thường, đôi khi thấy các hồng cầu chưa trưởng thành hoặc hồng cầu méo mó. Đếm số lượng hồng cầu lưới thường thấy thấp so với mức độ thiếu máu. Số lượng bạch cầu và tiểu cầu ở máu ngoại vi bình thường. Xét nghiệm tủy đồ thường chỉ thấy dòng hồng cầu giảm, không thấy tăng sinh dòng hồng cầu như các trường hợp thiếu máu khác.
Thiếu máu ở bệnh nhân suy thận mạn là hậu quả của giảm tạo hồng cầu, và giảm đời sống hồng cầu đóng góp thêm vào. Giảm đời sống hồng cầu là do hậu quả của môi trường ure máu cao. Người ta truyền hồng cầu của người ure máu cao cho người bình thường, thấy đời sống của hồng cầu bình thường. Ngược lại, khi truyền hồng cầu của người bình thường cho người tăng ure máu, thấy đời sống hồng cầu giảm. Các yếu tố thêm vào gây thiếu máu ở bệnh nhân suy thận mạn bao gồm mất máu, tan máu do nhiễm độc (trong một số bệnh thận người ta phát hiện thấy hoạt hóa bổ thể xảy ra trên màng hồng cầu gây phá hủy hồng cầu), cường lách, suy dinh dưỡng, thiếu các yếu tố tạo máu, nhiễm độc tủy xương, xơ hóa tủy xương.
Giảm sản sinh hồng cầu là do giảm EPO, đây là tác nhân chính gây thiếu máu ở bệnh nhân suy thận mạn. Bởi vì, khi được tiêm erythropoietin người tái tổ hợp thì số lượng hồng cầu và nồng độ huyết sắc tố phục hồi và trở về mức bình thường. Ngoài ra giảm sản sinh hồng cầu còn có một số yếu tố đóng góp thêm vào, như nhiễm độc tủy xương, thiếu sắt hoặc thiếu acid folic, nhiễm độc nhôm, xơ hóa tủy xương hậu quả của cường chức năng tuyến cận giáp thứ phát.
3.2. Động học của sắt ở bệnh nhân suy thận mạn
Ở người suy thận mạn thấy sắt huyết thanh, transferin, độ bão hòa sắt và ferritin bình thường. Tái hấp thu sắt từ ruột bình thường. Trong cơ thể, bình thường sắt được dự trữ ở hai nơi là hệ thống võng mô và trong tế bào hồng cầu, sắt tồn tại dưới hai dạng là sắt hem (sắt kết hợp) gồm hemoglobin và myoglobin và sắt không hem (sắt huyết thanh). Sắt không hem gắn với protein gồm hai loại là ferritin siderophilin và transferin lactoferin. Trong đó ferritin phản ánh chính xác lượng sắt trong cơ thể. Có ba xét nghiệm để đánh giá tình trạng dự trữ sắt. Thứ nhất là nồng độ ferritin huyết thanh, bình thường ở nam là 30-400mcg/l (ng/ml) và nữ là 15-150 mcg/l (ng/ml). Thứ hai là độ bão hòa transferin, bình thường là 25-55%. Thứ ba là nồng độ sắt huyết thanh, bình thường là 9,5-30 mcmol/l (49-151 mcg/dl) ở nam, và 8,8-27 mcmol/l (53-167 mcg/dl) ở nữ. Ở người suy thận mạn, thường thấy kết quả các xét nghiệm này vẫn trong giới hạn bình thường.
3.3. Sản sinh erythropoietin ở bệnh nhân bị bệnh thận
3.3.1. Ở bệnh nhân suy thận giai đoạn cuối
Nồng độ erythropoietin huyết thanh ở bệnh nhân suy thận giai đoạn cuối rất thấp nhưng vẫn định lượng được, trong trường hợp này người ta cho rằng EPO được tạo ra từ gan. Thiếu hụt sản sinh EPO của thận là nguyên nhân chính gây thiếu máu nặng ở bệnh nhân suy thận giai đoạn cuối. Khi điều trị bằng EPO người tái tổ hợp từ công nghệ gen, có thể đưa số lượng hồng cầu và nồng độ huyết sắc tố trở về mức bình thường ở những bệnh nhân này.
Một điều đáng lưu ý là thận suy không đủ khả năng sản xuất EPO để đáp ứng với mức độ thiếu máu, hầu như không phụ thuộc vào nguyên nhân dẫn đến suy thận giai đoạn cuối. Người ta vẫn chưa biết, liệu có phải do sự phá hủy các tế bào sản xuất EPO hay không, hay phụ thuộc vào sự nhạy cảm của thận với các kích thích sản sinh và giải phóng EPO, hay cả hai. Từ quan sát thận bị tổn thương đã giảm sản sinh EPO, sau khi ghép thận việc sản sinh EPO của thận ghép liên quan với chức năng bài tiết của thận ghép, người ta suy đoán rằng có sự đi đôi giữa chức năng bài tiết với chức năng nội tiết của thận ghép. Dường như có khả năng là, giảm nhạy cảm với thiếu oxy có thể là hậu quả của giảm tiêu thụ oxy của ống thận, và điều này có thể là lý do chính làm giảm sản sinh EPO ở bệnh nhân bị bệnh thận mạn tính hơn là do sự phá hủy các tế bào sản sinh EPO.
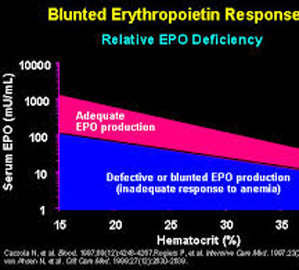
Tương quan giữa EPO huyết thanh và nồng độ hematocit
3.3.2. Bệnh thận đa nang
Mức độ thiếu máu ở bệnh nhân suy thận giai đoạn cuối do bệnh thận đa nang ít trầm trọng hơn suy thận do các bệnh thận khác. Nồng độ EPO trong huyết thanh ở bệnh nhân bị bệnh thận đa nang suy thận giai đoạn cuối cao hơn các bệnh nhân suy thận giai đoạn cuối không do bệnh thận đa nang. Các nghiên cứu gần đây thấy rằng, nồng độ EPO trong tĩnh mạch thận cao hơn trong động mạch thận ở bệnh nhân bị bệnh thận đa nang đã suy thận. Ngoài ra dịch nang có chứa một lượng EPO có hoạt tính sinh học với nồng độ trên 3 IU/ml. Nồng độ EPO trong dịch nang cao chỉ thấy ở các nang có nguồn gốc từ ống lượn gần, các tế bào thành nang có chứa mRNA của EPO. Người ta không tìm thấy mRNA của EPO ở các tế bào trong mô kẽ, tế bào cầu thận và tế bào ống thận ở những bệnh nhân này.
3.3.3. Thận ghép
Khi chức năng thận ghép bình thường, thì tình trạng thiếu máu được phục hồi trở về bình thường khoảng 3 tháng sau ghép. Nồng độ EPO trong huyết thanh của bệnh nhân sau ghép thận tăng trở về bình thường hoặc gần bình thường có vai trò chính trong việc điều chỉnh thiếu máu. Nồng độ EPO trong huyết thanh tăng tương quan thuận với tăng số lượng hồng cầu và tăng nồng độ huyết sắc tố ở những bệnh nhân có chức năng thận ghép tốt. Nồng độ EPO trong huyết thanh tăng trung bình 18-35 mIU/ml trong vòng 7 ngày sau ghép, và tiếp tục tăng cho đến khi thiếu máu được phục hồi về bình thường. Sau khi số lượng hồng cầu và nồng độ hemoglobin máu trở lại mức bình thường, thì nồng độ EPO trong huyết thanh trở về mức cơ bản. Cơ chế thông báo ngược (feedback) để điều chỉnh sản xuất EPO và nồng độ hemoglobin huyết thanh sau ghép thận đòi hỏi chức năng của thận ghép tốt.
3.3.4. Hẹp động mạch thận
Ở những bệnh nhân bị hẹp động mạch thận, cung cấp oxy cho thận giảm, nhưng các nghiên cứu cho thấy việc sản sinh EPO trong tình huống này rất khác nhau, đôi khi trái ngược nhau. Ở động vật thực nghiệm, tăng sản sinh EPO sau khi gây hẹp động mạch thận thấy ở một số thực nghiệm, nhưng không phải thấy ở tất cả các thực nghiệm. Một số nghiên cứu thực nghiệm trên chuột cho thấy, khi gây giảm 10% dòng máu thận thì nồng độ EPO trong huyết thanh tăng gấp 3 lần. Kết quả này cho thấy, sản sinh EPO khá nhạy cảm với thay đổi dòng máu thận. Một số thực nghiệm khác lại không thấy tăng nồng độ EPO huyết thanh sau khi gây hẹp động mạch thận. Điều này có thể được lý giải là tỉ số giữa lượng oxy đòi hỏi và lượng oxy cung cấp đóng vai trò chi phối sản xuất EPO, khi giảm dòng máu thận, sẽ làm giảm dòng natri trong ống thận, do đó làm giảm nhu cầu oxy của ống thận, làm cho tỉ số trên không thay đổi.
3.3.5. Các khối u thận
U thận đôi khi thấy kết hợp với đa hồng cầu, nhưng nồng độ EPO trong huyết thanh của những bệnh nhân này không được định lượng, nên tăng số lượng hồng cầu có phải là hậu quả của tăng EPO hay không chưa được khẳng định. Ngay cả nếu có tăng EPO trong huyết thanh thì vấn đề là, liệu EPO được sản xuất bởi tế bào khối u hay bởi các mô liền kề cũng chưa được biết. Vấn đề này cần được nghiên cứu tiếp.
3.3.6. Thuốc và sản sinh erythropoietin
Sự giao thoa giữa thuốc và sản sinh EPO chưa được nghiên cứu, có một số quan sát cho thấy thuốc có ảnh hưởng đến sản sinh EPO.
Người ta đã biết, việc sản sinh EPO chịu ảnh hưởng của mức tiêu thụ oxy của ống lượn gần. Người ta cho rằng các thuốc tác động lên chức năng ống lượn gần sẽ ảnh hưởng lên sản sinh EPO. Thực tế cho thấy, sử dụng acetazolamid đã làm giảm sản sinh EPO khi đáp ứng với thiếu oxy. Điều này đã được quan sát thấy ở cả động vật thực nghiệm và ở người.
Có một số báo cáo lâm sàng về điều trị bằng thuốc ức chế men chuyển ảnh hưởng tới sản sinh EPO. Thực nghiệm trên chuột có dấu hiệu cho thấy, điều trị bằng catoprin có thể làm giảm sản sinh EPO, nhưng cơ chế của hiện tượng này, và liệu có xảy ra trên người hay không thì chưa được biết.
Chất ức chế cyclooxygenase như indomethaxin đã được báo cáo là gây ức chế sản sinh EPO trong đáp ứng với thiếu oxy và thiếu máu ở chó và ở chuột thực nghiệm. Liệu ảnh hưởng này có xảy ra trên người hay không thì không được biết.
Sử dụng thuốc chẹn dòng calci, đã được báo cáo thấy có tác dụng làm tăng sản sinh EPO ở chuột nhắt. Chẳng hạn, khi cho chuột uống verapamin với liều 5-20 mg/kg thấy tăng sản xuất EPO khi đáp ứng với thiếu oxy, so sánh với các con chuột không được điều trị.
3.4. Các yếu tố góp phần làm giảm sản sinh hồng cầu ở người tăng ure máu
3.4.1. “Chất ức chế sản sinh hồng cầu” ở người tăng ure máu
Tiến triển tốt lên của tình trạng thiếu máu sau khi bắt đầu lọc máu ở bệnh nhân suy thận giai đoạn cuối, được mô tả lần đầu tiên vào 1970 (Eschbach va cs 1970). Điều đó khiến người ta nghĩ rằng có các yếu tố “ức chế sản sinh hồng cầu” ở người tăng ure máu, và lọc máu đã giúp loại bỏ các chất độc với tủy xương. Dấu hiệu ủng hộ cho lý thuyết rằng có “các chất ức chế sản sinh hồng cầu” bắt nguồn từ thực nghiệm nuôi cấy tế bào tủy xương trên invitro. Khi nuôi cấy tủy xương chó, thêm vào môi trường nuôi cấy huyết thanh của người tăng ure máu, thấy xảy ra hiện tượng ức chế sản sinh hồng cầu. Nhưng tủy xương không bị ức chế bởi ure, creatinin, hoặc acid guadinosuccinic, khi thêm vào môi trường nuôi cấy một cách riêng biệt. Kết quả thu được tương tự khi nuôi cấy tủy xương của chuột, thỏ, và tế bào gan chuột, được thêm vào môi trường nuôi cấy huyết thanh của người tăng ure máu. Dòng tế bào sản sinh hồng cầu cũng chậm phát triển rõ trong môi trường nuôi cấy có huyết thanh của người tăng ure máu, so với có huyết thanh của người bình thường. Hơn 20 năm qua, nhiều chất đã được cho là có vai trò ức chế tạo hồng cầu, nhưng cho đến nay không có chất nào được xác định là có tác dụng ức chế tạo hồng cầu. Nếu các chất này tồn tại thì chúng cũng chỉ có vai trò rất nhỏ trong thiếu máu ở bệnh nhân suy thận mạn. Một số chất đã được gợi ý là có tác dụng ức chế sản sinh hồng cầu là các lipid có cực, asen, spermin, spermidin, vitamin A và parathiroid hormon. Tác dụng ức chế tạo hồng cầu của parathyroid hormon không được xác định, nhưng có lẽ parathyroid hormon gây xơ hóa tủy xương do đó làm giảm sản sinh hồng cầu. Quá tải nhôm ở bệnh nhân lọc máu được biết rõ là nguyên nhân của rối loạn tâm thần và bệnh xương. Hiện nay nhiễm độc nhôm ít gặp, do các phương pháp lọc nước hiện đại đã được dùng trong lọc máu và hạn chế sử dụng hydroxyt nhôm trong điều trị tăng phosphat máu. Quá tải nhôm trầm trọng ở bệnh nhân lọc máu, thường kết hợp với thiếu máu hồng cầu nhỏ. Biến chứng này giảm đi khi nhôm trong dịch lọc giảm do hấp phụ ion trong nước pha dịch lọc, hoặc bệnh nhân được điều trị bằng desferrioxamin truyền tĩnh mạch. Ở những con vật gây quá tải nhôm, thấy xuất hiện thiếu máu hồng cầu nhỏ nếu có giảm chức năng thận, nhưng thiếu máu hồng cầu to nếu chức năng thận bình thường. Những nghiên cứu gần đây, khi điều trị bằng desferrioxamin cho bệnh nhân lọc máu chu kỳ bị quá tải nhôm, cho thấy tình trạng thiếu máu tốt lên. Tác dụng tốt lên của tình trạng thiếu máu khi điều trị bằng desferrioxamin, gợi ý vai trò của nhôm gây ức chế tạo hồng cầu ở tủy xương (Mladenovic 1988).
3.4.2. Thiếu sắt và acid folic
Trước đây lượng máu mất trong quá trình lọc máu vào khoảng 2,5 lít/năm, nhưng hiện nay với các phương tiện hiện đại, số lượng máu mất chỉ khoảng 4-20 ml cho một lần lọc máu. Thêm vào đó, một số máu lấy mẫu để xét nghiệm huyết học và sinh hóa, cũng làm mất một lượng nhỏ máu. Tính lượng sắt từ lượng máu mất trong thời gian lọc máu, cũng như mất máu qua đường tiêu hóa, qua nước tiểu hoặc kinh nguyệt, thì bệnh nhân lọc máu mất một lượng sắt hàng ngày khoảng 2 mg. Trong thức ăn hàng ngày, trung bình có khoảng 14 mg sắt, trong điều kiện bình thường chỉ 10% lượng sắt từ thức ăn được hấp thu, do đó dễ dàng thấy bệnh nhân lọc máu chu kỳ có thể thiếu sắt. Hiện nay sắt có thể cung cấp bằng đường uống. Nồng độ sắt huyết thanh và transferin không phản ánh lượng sắt dự trữ ở bệnh nhân suy thận. Dự trữ sắt được ước lượng tốt nhất bằng phương pháp đo nồng độ ferritin huyết thanh, nếu nồng độ ferritin huyết thanh thấp hơn 80-100 mcg/l gợi ý có thiếu sắt. Nhuộm màu tủy xương bằng hemosiderin có thể cho phép đánh giá chính xác lượng sắt dự trữ. Gần đây dự trữ sắt có thể tính theo công thức được Van Wyck và cs đưa ra 1989 như sau:
Dự trữ sắt (mg) = 400.(log[ferritin] - log(30))
Quá tải sắt khi mức ferritin huyết thanh trên 500 mcg/l.
Folat cần cho tổng hợp DNA, khi thiếu folat gây thiếu máu nguyên hồng cầu khổng lồ. Đánh giá dự trữ folat tốt nhất là định lượng folat trong hồng cầu. Lượng folat đòi hỏi hàng ngày khoảng 100 mcg, thức ăn bình thường cung cấp thường không đủ. Ngoài ra còn mất folat do lọc máu, do đó bệnh nhân lọc máu cần được uống folat. Folat không bị mất do lọc màng bụng, thiếu folat ở những bệnh nhân này đơn giản là ăn không đủ. Một số thuốc sử dụng để điều trị bệnh ác tính có tác dụng đối kháng với folat, nhưng ít gặp trường hợp phải dùng các thuốc này ở bệnh nhân suy thận. Thuốc chống co giật như là phenyltoin cũng làm tăng thiếu folat, cơ chế chưa rõ nhưng có lẽ liên quan với làm các enzym ở gan tăng chuyển hóa folat.
3.4.3. Vai trò của ly giải máu
Người ta thấy đời sống hồng cầu giảm ở người tăng ure máu. Giảm đời sống hồng cầu ở người tăng ure máu có liên quan với nồng độ ure máu. Một số trường hợp thấy đời sống hồng cầu tăng lên sau khi điều trị thay thế thận bằng lọc máu. Một số bệnh nhân lọc máu có đời sống hồng cầu ngắn hơn, và lâm sàng có dấu hiệu tan máu đã được báo cáo. Những bệnh nhân này có tình trạng nhiễm độc nặng với formaldehyd, đồng, cloramin và nitrat. Nhiễm độc kẽm cũng gây thiếu máu, cơ chế chưa được rõ. Nitrat gây methemoglobin và gây ra thiếu máu. Formaldehyd dùng để khử trùng quả lọc, và các chất độc khác có trong nước dùng để pha dịch lọc có thể gây ly giải hồng cầu.
3.4.4. Vai trò của nhiễm khuẩn
Nhiễm khuẩn mạn tính thường kết hợp với thiếu máu. Các bệnh lý viêm mạn tính làm giảm hiệu quả của điều trị thiếu máu bằng erythropoietin người tái tổ hợp. Giảm đáp ứng với EPO biểu hiện bằng giảm số lượng hồng cầu lưới và giảm nồng độ hemoglobin. Những bệnh nhân bị nhiễm khuẩn mạn tính, thấy giảm đáp ứng với điều trị bằng EPO.
4. Các khía cạnh lâm sàng của thiếu máu ở người suy thận mạn
4.1. Các biểu hiện thường gặp của thiếu máu ở người suy thận mạn
Thiếu máu ở người suy thận mạn tiến triển tương ứng với mức độ suy giảm chức năng thận, thường có dấu hiệu tốt lên sau khi được lọc máu chu kỳ. Tuy nhiên, có một số lượng ít bệnh nhân lọc máu chu kỳ (khoảng 10%) bị phụ thuộc vào truyền máu. Những bệnh nhân lọc máu chu kỳ bằng thận nhân tạo, tình trạng thiếu máu thường nặng hơn khi so sánh với nhóm lọc màng bụng. Tuy nhiên cũng cần lưu ý, mẫu máu xét nghiệm của những bệnh nhân lọc máu bằng thận nhân tạo chu kỳ được lấy ngay trước khi lọc máu, khi mà máu bị hòa loãng do quá tải dịch, trong khi những bệnh nhân lọc màng bụng không có hiện tượng này. Những bệnh nhân lọc máu chu kỳ do bị bệnh thận đa nang người lớn, có nồng độ hemoglobin huyết thanh cao hơn các bệnh nhân bị suy thận do các nguyên nhân khác. Đôi khi người ta thấy có tăng nồng độ hemoglobin và thấy chứng tăng hồng cầu xảy ra ở bệnh nhân bị bệnh thận đa nang. Điều này được giải thích là do tăng nồng độ EPO được giải phóng từ các nang thận.
4.2. Hậu quả của thiếu máu trong suy thận mạn
Thiếu máu là tình trạng giảm số lượng hồng cầu và giảm nồng độ hemoglobin, gây thiếu hụt đáp ứng oxy theo nhu cầu của các mô trong cơ thể. Điều này gây ra nhiều triệu chứng và dấu hiệu khác nhau ở bệnh nhân suy thận mạn. Những triệu chứng do thiếu máu gây ra khó tách biệt với triệu chứng tăng ure máu. Thực tế thấy rằng, những bệnh nhân suy thận mạn được điều trị bằng EPO, thì nhiều triệu chứng trước đây vẫn được cho là do tăng ure máu, đã biến mất hoặc giảm đi rõ rệt, và như vậy chúng chỉ đơn giản là do thiếu máu.
Sự thích nghi sinh lý đối với thiếu máu ở bệnh nhân suy thận mạn biểu hiện bằng tăng độ bão hòa oxy của hemoglobin, tăng cung lượng tim, giảm lượng máu đến da để tăng dòng máu đến các cơ quan khác. Các triệu chứng thiếu máu biểu hiện bằng mệt mỏi, khó thở khi gắng sức, đau tức ngực, hồi hộp đánh trống ngực, tăng nhạy cảm với lạnh, ăn không ngon miệng, giảm hưng phấn tình dục, rối loạn kinh nguyệt, da xanh tái, nhịp tim nhanh, phù mô kẽ phổi, tràn dịch màng ngoài tim.
4.3. Tạng chảy máu
Suy thận mạn nặng thường kết hợp với xu hướng dễ chảy máu, đặc trưng bởi thời gian chảy máu kéo dài. Mặc dù tăng ure máu gây tác động rất ít lên các yếu tố đông máu và chức năng tiểu cầu, nhưng có lẽ hematocrit có tầm quan trọng. Khi tăng hematocrit lên mức bình thường, thấy điều chỉnh được thời gian chảy máu trở về bình thường. Điều này xảy ra khi truyền khối hồng cầu hoặc điều trị bằng EPO.
4.4. ảnh hưởng lên tim mạch
Hậu quả của thiếu máu nặng là giảm cung cấp oxy cho mô, độ nhớt máu giảm làm giảm sức kháng mạch ngoại vi, giảm sức kháng tĩnh mạch làm hồi lưu máu tĩnh mạch tốt hơn, và làm cung lượng tim tăng. Kết quả siêu âm tim ở bệnh nhân suy thận giai đoạn cuối thấy tăng đường kính cuối tâm trương thất trái, dày vách liên thất và thành sau thất trái. Khi quá tải áp lực và thể tích mạn tính làm giảm sức bóp cơ tim.
Sau ghép thận và điều trị thiếu máu bằng EPO, thấy các triệu chứng tim mạch giảm, đường kính thất trái cuối tâm trương giảm về gần bình thường, dày vách liên thất và thành sau thất trái giảm, chỉ số tim/lồng ngực giảm, cung lượng tim trở về bình thường, phân số tống máu thất trái tăng lên (Hà Hoàng Kiệm, báo cáo tại Hội nghị Quân y Châu Á-Thái Bình Dương lần thứ XV, 2005). Các kết quả trên gợi ý thiếu máu là nguyên nhân quan trọng gây ra các bất thường tim mạch ở bệnh nhân suy thận mạn.
5. Phòng và điều trị thiếu máu ở người suy thận mạn
5.1. Dự phòng
Bệnh nhân bị suy thận mạn đòi hỏi chế độ ăn hạn chế protein từ trước khi suy thận giai đoạn cuối. Do hạn chế trong chế độ ăn, có thể làm tình trạng thiếu hụt năng lượng và các yếu tố cần thiết cho tạo máu. Nếu thiếu máu xuất hiện ngày càng nặng hơn, thì có thể xảy ra thiếu sắt hoặc thiếu folat. Thiếu sắt, phản ánh bằng thiếu máu nhược sắc hồng cầu nhỏ. Uống bổ xung sắt hầu như luôn được khuyến cáo, ngoại trừ những bệnh nhân không uống được sắt, hoặc những bệnh nhân bị mất máu cần bổ xung sắt bằng đường tiêm tĩnh mạch.
Điều trị bằng lọc máu sớm với bệnh nhân suy thận giai đoạn cuối, có thể dự phòng được tình trạng phụ thuộc vào truyền máu, và làm tăng được nồng độ hemoglobin và số lượng hồng cầu. Mức độ tốt lên của tình trạng thiếu máu liên quan với lọc máu hiệu quả.
5.2. Điều chỉnh thiếu máu
5.2.1. Lọc máu
Tình trạng thiếu máu tốt lên sau vài tháng bắt đầu lọc máu và mức độ tốt lên liên quan với lọc máu hiệu quả. Kết quả này là do kéo dài đời sống hồng cầu, tăng hemoglobin ở bệnh nhân lọc màng bụng tốt hơn bệnh nhân lọc máu bằng thận nhân tạo. Nhưng tác dụng này thường không kéo dài quá 3 năm, kể từ khi bắt đầu lọc máu. Nồng độ EPO huyết thanh giảm hoặc không thay đổi trong thời kỳ đầu lọc máu. Giảm bớt hydroxyt nhôm đường uống (là chất mang phosphat), và dùng nước pha dịch lọc chất lượng cao, sẽ làm giảm các tác nhân xấu gây thiếu máu.
5.2.2. Truyền máu
Truyền máu định kỳ giúp ngăn chặn tình trạng thiếu máu và làm tăng tưới máu mô, đáp ứng với đòi hỏi cung cấp oxy của mô. Hiện nay có sẵn EPO người tái tổ hợp để điều trị thiếu máu đã làm giảm đáng kể nhu cầu truyền máu ở bệnh nhân lọc máu chu kỳ. Truyền khối hồng cầu làm giảm triệu chứng của thiếu máu như giảm đau ngực, giảm khó thở, giảm chóng mặt và tình trạng xây xẩm. Truyền máu định kỳ dễ làm quá tải sắt, nhiễm virus, cũng như làm xuất hiện ở bệnh nhân các kháng thể kháng lại kháng nguyên HLA (phát hiện bằng xét nghiệm độ mẫm cảm trước ghép dương tính), do đó làm giảm cơ hội ghép thận thành công. Biến chứng của truyền máu có thể gặp:
+ Quá tải sắt: truyền máu nhiều gây tình trạng ứ đọng sắt và nhiễm sắt ở các cơ quan. Nhiễm sắt tim có thể gây suy tim, nhiễm sắt gan, tụy và các tuyến nội tiết có thể gây rối loạn chức năng các cơ quan này.
+ Phụ thuộc vào truyền máu: truyền máu nhiều lần để điều trị thiếu máu sẽ gây hậu quả ức chế tủy xương tạo hồng cầu, dẫn tới tình trạng phụ thuộc vào truyền máu, bệnh nhân phải truyền máu vĩnh viễn.
+ Nhiễm virus: truyền máu ở bệnh nhân lọc máu làm tăng nguy cơ nhiễm các virus sinh sản trong máu, như virus viêm gan B, virus viêm gan C, cytomegalovirus, HIV, làm tăng tỉ lệ bệnh và tỉ lệ tử vong ở các bệnh nhân này, làm giảm cơ hội ghép thận thành công.
+ Sản sinh kháng thể độc tế bào: truyền máu nhiều lần làm cơ thể bệnh nhân sản sinh các kháng thể độc tế bào, các kháng thể kháng lại kháng nguyên HLA (biểu hiện phản ứng mẫn cảm trước ghép dương tính), là cản trở chính cho thành công của ghép thận. Truyền máu nhiều lần sẽ làm bệnh nhân phơi nhiễm với một phổ rộng các kháng nguyên HLA, hậu quả là cơ thể bệnh nhân sản sinh ra kháng thể chống lại nhiều kháng nguyên, thường gây phản ứng chéo giữa các kháng nguyên, do đó làm tăng tỉ lệ dương tính của phản ứng đọ chéo (cross-match) và làm tăng các rủi ro thải ghép cấp khi bệnh nhân được ghép thận.
5.2.3. Sử dụng các steroid đồng hóa
Androgen có tác dụng kích thích mô thận còn lại hoặc gan sản sinh EPO. Đáp ứng với điều trị bằng androgen ở bệnh nhân lọc máu sẽ tốt hơn nếu androgen được dùng cách quãng. Một tỉ lệ bệnh nhân thiếu máu do suy thận mạn đã giảm được đòi hỏi truyền máu khi sử dụng androgen. Tuy nhiên các tác dụng phụ của androgen như nam hóa, tổn thương cơ và gan, tăng cholesterol, gặp tới 25% số bệnh nhân được dùng androgen, nên hiện nay cũng ít được dùng.
5.2.4. Điều trị thay thế bằng erythropoietin
5.2.4.1. Dược động học của erythropoietin người tái tổ hợp (rHu-EPO)
Từ 1981 đến 1983 nhóm nghiên cứu bao gồm Linsk, Suggs, Jacobsk, Shocmaker, Rudersdorf và các cs, đã xác định được mẫu gen tổng hợp EPO. Mẫu gen đầu tiên được tạo lập và được cấy vào buồng trứng chuột lang, các tế bào buồng trứng chuột lang đã sản sinh được EPO giống hệt EPO của người, và được gọi là erythropoietin người tái tổ hợp từ công nghệ gen, viết tắt là rHu-EPO (recombinant Human – Erythropoietin). 1985 Joseph Eschbach cùng các cs, lần đầu tiên sử dụng rHu-EPO trên người và đã chứng minh tác dụng và tính an toàn của thuốc.
Hiện nay đã có sẵn rHu-EPO để sử dụng trong lâm sàng. Do các biệt dược có nguồn gốc khác nhau, nên dược động học của chúng cũng khác nhau. Các nghiên cứu dược động học của rHu-EPO ở bệnh nhân lọc máu chu kỳ được tiêm rHu-EPO, thấy nửa đời sống của rHu-EPO từ 4,9-9,3 giờ (Egrie và cs 1988; Cotes và cs 1989), liều đầu có t1/2 dài hơn các liều tiếp sau. Dược động học của rHu-EPO ở bệnh nhân lọc máu chu kỳ tương tự như ở người bình thường, gợi ý rằng sự bài tiết của thận với EPO là không quan trọng đối với đời sống của EPO. Sau khi tiêm dưới da, nồng độ tối đa của rHu-EPO trong máu đạt được sau 8-12 giờ, và nồng độ tối đa chỉ bằng 10% so với tiêm tĩnh mạch cùng liều. Sau 7 liều tiêm dưới da, nồng độ đỉnh đạt được 40-70% so với liều đầu.
Nghiên cứu dược động học, cũng đã được tiến hành ở bệnh nhân lọc màng bụng. Dược động học của đường tiêm tĩnh mạch tương tự như ở bệnh nhân lọc máu bằng thận nhân tạo (Hughes và cs 1989). Sau khi tiêm dưới da, nồng độ đỉnh trong máu đạt được sau 8-22 giờ. Tiêm dưới da rHu-EPO, cần liều thấp hơn so với tiêm tĩnh mạch để đạt được cùng mức hiệu quả chống thiếu máu (Stevens và cs 1989). Đưa rHu-EPO vào dịch lọc màng bụng cũng đã được nghiên cứu. Để gây ra được dược động học tương tự như dược động học của liều tiêm dưới da, thì liều thuốc đưa vào dịch lọc màng bụng thấp hơn 5-10 lần liều tiêm dưới da, nhưng phải lưu dịch lọc màng bụng kéo dài 10-12 giờ. Cách đưa thuốc này có thể làm giảm hiệu quả của lọc màng bụng và làm tăng nguy cơ viêm màng bụng vì phải lưu dịch kéo dài.
5.2.4.2. Tác dụng không mong muốn của rHu-EPO
Tác dụng không mong muốn của rHu-EPO chủ yếu xuất phát từ tăng hematocrit, tăng hematocrit làm xấu thêm tình trạng tăng huyết áp. Một số bệnh nhân chưa có tăng huyết áp trở thành tăng huyết áp, những bệnh nhân có tăng huyết áp đòi hỏi phải dùng tăng liều thuốc hạ huyết áp, một số bệnh nhân có thể xảy ra hội chứng não do tăng huyết áp hoặc xuất huyết não. Các biến chứng này hay xảy ra trong tháng đầu điều trị và xuất hiện cùng với giai đoạn tăng hematocrit. Để hạn chế nguy cơ này, cần giữ cho tốc độ tăng hemoglobin ít hơn 5g/dl/tuần, và chỉ tăng hemoglobin lên không quá 110g/l, tốt nhất là 100-110g/l. Cơ chế của tăng huyết áp khi điều trị bằng rHu-EPO chưa được biết đầy đủ, nhưng có lẽ liên quan tới sức kháng mạch ngoại vi tăng, và độ nhớt máu tăng. Sức kháng mạch ngoại vi tăng là do giảm giãn mạch vì được cung cấp đủ oxy, thêm vào đó tăng độ nhớt máu toàn bộ về giới hạn bình thường. Tác dụng này lên tăng huyết áp cũng được quan sát thấy ở những bệnh nhân được truyền máu. Khả năng khác có thể còn do tăng thể tích huyết tương, tăng thể tích máu toàn bộ có liên quan đến hệ renin-angiotensin-aldosterol.
Tăng hematocrit, tăng độ nhớt máu, làm tăng nguy cơ huyết khối. Hiện tượng huyết khối, nghẽn mạch hầu hết xảy ra ở lỗ thông động-tĩnh mạch (fistula).
Thiếu sắt gặp ở hầu hết các bệnh nhân khi được điều trị bằng rHu-EPO. Tình trạng thiếu sắt chức năng cũng xảy ra ở bệnh nhân quá tải sắt, bởi vì sắt dự trữ không được huy động đủ nhanh để đáp ứng với tăng hoạt động của tủy xương tạo hồng cầu. Có thể dự đoán nhu cầu sắt trong thời gian điều trị bằng rHu-EPO bằng định lượng ferritin huyết thanh
Một số nghiên cứu nhận thấy có tăng nhẹ số lượng tiểu cầu ở bệnh nhân lọc máu được tiêm rHu-EPO, nhưng số lượng tiểu cầu chỉ ở giới hạn trên của giá trị bình thường (Bommer và cs 1987, Casiti và cs 1987). Điều này phản ánh rHu-EPO có tác dụng kích thích megacaryocyt hoặc đáp ứng liên quan với thiếu sắt. Số lượng bạch cầu không thay đổi khi điều trị bằng rHu-EPO.
Một số báo cáo có dấu hiệu giảm hiệu quả lọc máu trong thời gian điều trị bằng rHu-EPO do tăng hematocrit, tăng độ nhớt máu, nhưng các thử nghiệm lâm sàng cho đến nay không xác định điều này. Tuy vậy, khi điều trị bằng rHu-EPO, bệnh nhân ăn tốt hơn, tăng trọng lượng, do đó cũng đòi hỏi phải tăng lọc máu để duy trì nồng độ nitơ phiprotein trong máu, nồng độ phosphat và kali máu như trước đây. Không thấy ảnh hưởng đến hiệu quả lọc màng bụng khi bệnh nhân được điều trị bằng rHu-EPO.
Một số bệnh nhân được lọc máu chu kỳ được điều trị bằng rHu-EPO có biểu hiện hội chứng giống cúm. Bệnh nhân có cảm giác sốt, mặc dù nhiệt độ cơ thể bình thường, đau mỏi xương khớp. Các triệu chứng này thường nhẹ, có thể tránh được bằng tiêm chậm rHu-EPO, hoặc dùng aspirin, paracetamol. Hội chứng giống cúm chỉ gặp ở những bệnh nhân được tiêm rHu-EPO đường tĩnh mạch, không thấy ở những bệnh nhân được tiêm dưới da.
5.2.4.3. Liều lượng điều trị
Với liều thấp 15 IU/kg tiêm 3 lần/tuần cho kết quả tăng hemoglobin chậm. Đáp ứng tối đa thấy khi tiêm với liều 500 IU/kg tiêm 3 lần/tuần, với liều cao hơn không thấy đáp ứng thêm. Những nghiên cứu đa trung tâm lớn đã xác định liều này (Sundal và cs 1989).
Nồng độ hemoglobin tối đa cần đưa lên chưa được xác định rõ ràng. Sự thích nghi sinh lý với tình trạng thiếu máu ở bệnh nhân tăng ure máu, cho phép không cần đưa nồng độ hemoglobin về giới hạn bình thường để đạt được mức tốt lên tối đa của triệu chứng. Người ta chấp nhận chỉ nên đưa nồng độ hemoglobin lên 100-110 g/l là thích hợp. Với nồng độ hemoglobin như vậy đủ để làm giảm triệu chứng và hạn chế bộc lộ các tác dụng không mong muốn của rHu-EPO, vì các bệnh nhân tăng ure máu thường có tồn tại bệnh lý về mạch máu.
Hầu hết các bệnh nhân đáp ứng với liều tiêm tĩnh mạch, khởi đầu 50 IU/kg tiêm3 lần/tuần. Nồng độ hemoglobin mong muốn sẽ đạt được sau 3-4 tuần điều trị. Khi tăng hemoglobin hơn 5 g/l/tuần có thể gây tăng huyết áp, nên cần dùng liều thấp và tăng liều chậm. Khi nồng độ hemoglobin đạt được mục tiêu, cần giảm liều rHu-EPO để duy trì. Nồng độ hemoglobin trước điều trị ảnh hưởng đến liều điều trị cần dùng, những bệnh nhân thiếu máu nhiều hơn, đòi hỏi liều ban đầu cao hơn. Khi tiêm dưới da có thể hạ được liều cần điều trị, nhưng một số nghiên cứu gần đây cho thấy tiêm dưới da có thể gây kích thích tạo kháng thể, vì vậy hiện nay người ta khuyến cáo nên sử dụng đường tiêm tĩnh mạch.
Những bệnh nhân suy thận có thiếu máu nặng nhưng chưa đòi hỏi phải lọc máu chu kỳ, được tiêm tĩnh mạch rHu-EPO ba lần mỗi tuần cũng đạt được kết quả điều trị thiếu máu. Các nghiên cứu trên động vật gợi ý tăng hematocrit có thể làm nhanh thêm tiến triển của suy thận (Garcia và cs 1988), nhưng các nghiên cứu trên người chưa thấy điều này.
Các bệnh nhân bị thiếu máu do suy thận mạn mà không có các nguyên nhân khác gây thiếu máu, thì thiếu máu có thể được điều chỉnh hoàn toàn với điều trị bằng rHu-EPO. Tuy nhiên có khoảng 10% bệnh nhân lọc máu chu kỳ đáp ứng kém với điều trị bằng rHu-EPO. Các nguyên nhân gây đáp ứng kém với rHu-EPO có thể là thiếu sắt, xơ hóa tủy xương, thiếu protein năng lượng. Cần phải định lượng nồng độ ferritin huyết thanh để bổ xung đầy đủ sắt. Xem xét tình trạng tăng parathyroid hormon, hoặc nhiễm độc nhôm gây nhiễm độc tủy xương hoặc xơ hóa tủy xương để có biện pháp xử lý.
6. Thiếu máu ở trẻ em suy thận mạn
6.1. Đặc điểm thiếu máu ở trẻ em suy thận mạn
Mặc dù thiếu máu không phải là vấn đề lớn ở trẻ em trước khi bị suy thận giai đoạn cuối. Nhưng những trẻ em phải lọc máu chu kỳ thường đòi hỏi phải truyền máu nhiều hơn so với người lớn. Không giống như những bệnh nhân bị bệnh thận đa nang người lớn, bệnh thận đa nang ở trẻ em không được bảo vệ khỏi thiếu máu.
Bệnh nguyên của thiếu máu ở trẻ em suy thận mạn tương tự ở người lớn. Những bệnh nhân không được truyền máu thường thấy có thiếu sắt, bởi vì nôn và hạn chế trong chế độ ăn. Đánh giá dự trữ sắt của cơ thể tốt nhất vẫn là định lượng nồng độ ferritin huyết thanh. Sử dụng androgen ở trẻ em suy thận mạn có lợi cho mục đích tăng trưởng, và cũng có lợi cho điều trị thiếu máu.
6.2. Điều trị erythropoietin ở trẻ em
rHu-EPO tiêm tĩnh mạch ba lần mỗi tuần với liều tương tự liều của người lớn là cần thiết với trẻ em lọc máu chu kỳ. Truyền máu có thể gây ra hậu quả kích thích cơ thể sản sinh ra kháng thể kháng HLA, làm tăng tỉ lệ dương tính của xét nghiệm độ mẫn cảm trước ghép và phản ứng đọ chéo, làm giảm cơ hội ghép thận thành công, nên cần hạn chế.
Nguồn: Hà Hoàng Kiệm. Thận học lâm sàng. NXB YH. 2010.
.JPG)






.JPG)
.JPG)